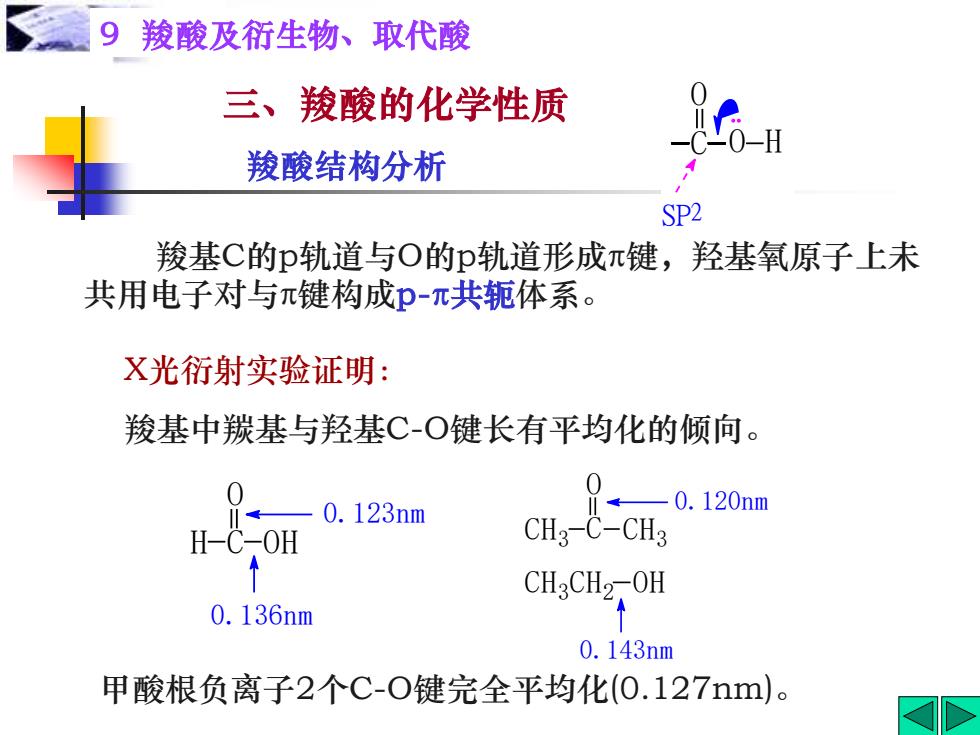
9羧酸及衍生物、取代酸 三、羧酸的化学性质 G- 羧酸结构分析 SP2 羧基C的p轨道与O的p轨道形成π键,羟基氧原子上未 共用电子对与π键构成p-π共轭体系。 X光衍射实验证明: 羧基中羰基与羟基C-O键长有平均化的倾向。 0 0.123nm 0.120nm H-C-OH CH3-C-CH3 CH3CH2-0H 0.136nm 0.143nm 甲酸根负离子2个C-O键完全平均化(0.127nm)
羧基C的p轨道与O的p轨道形成π键,羟基氧原子上未 共用电子对与π键构成p-π共轭体系。 甲酸根负离子2个C-O键完全平均化(0.127nm)。 三、羧酸的化学性质 9 羧酸及衍生物、取代酸 羧酸结构分析 X光衍射实验证明: 羧基中羰基与羟基C-O键长有平均化的倾向。 C O H O SP2 0.143nm CH3 CH2 OH 0.120nm CH3 C CH3 O 0.136nm 0.123nm H C OH O
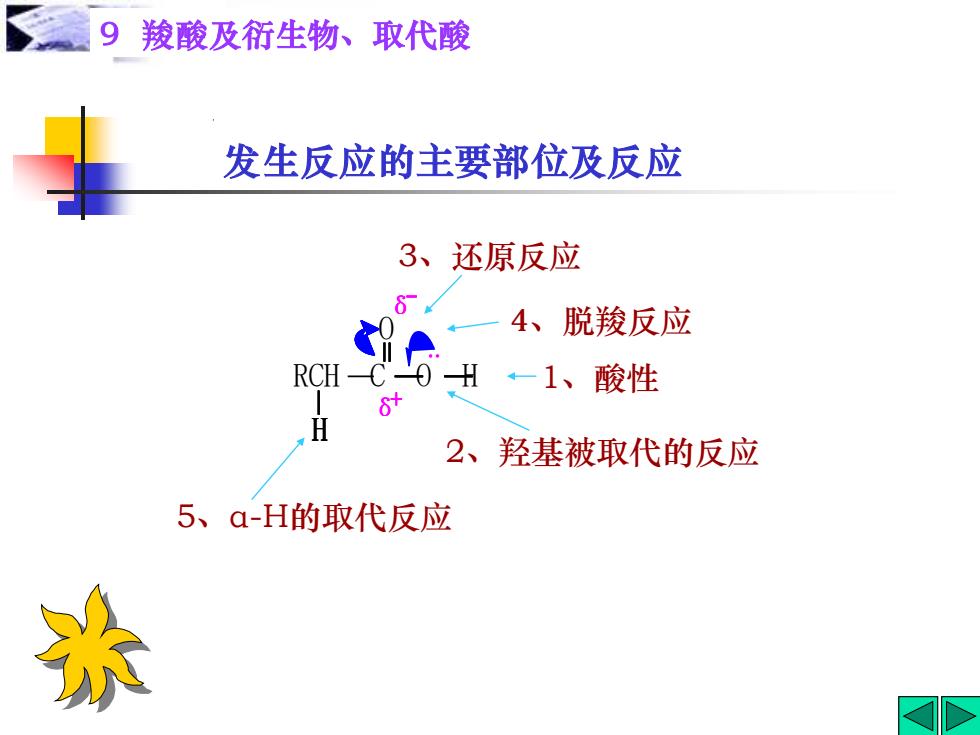
9羧酸及衍生物、取代酸 发生反应的主要部位及反应 3、还原反应 4、脱羧反应 RCH-C H -1、酸性 2、羟基被取代的反应 5、a-H的取代反应 杂
9 羧酸及衍生物、取代酸 发生反应的主要部位及反应 1、酸性 4、脱羧反应 3、还原反应 5、α-H的取代反应 2、羟基被取代的反应 + δ δ RCH C O H H O + δ δ
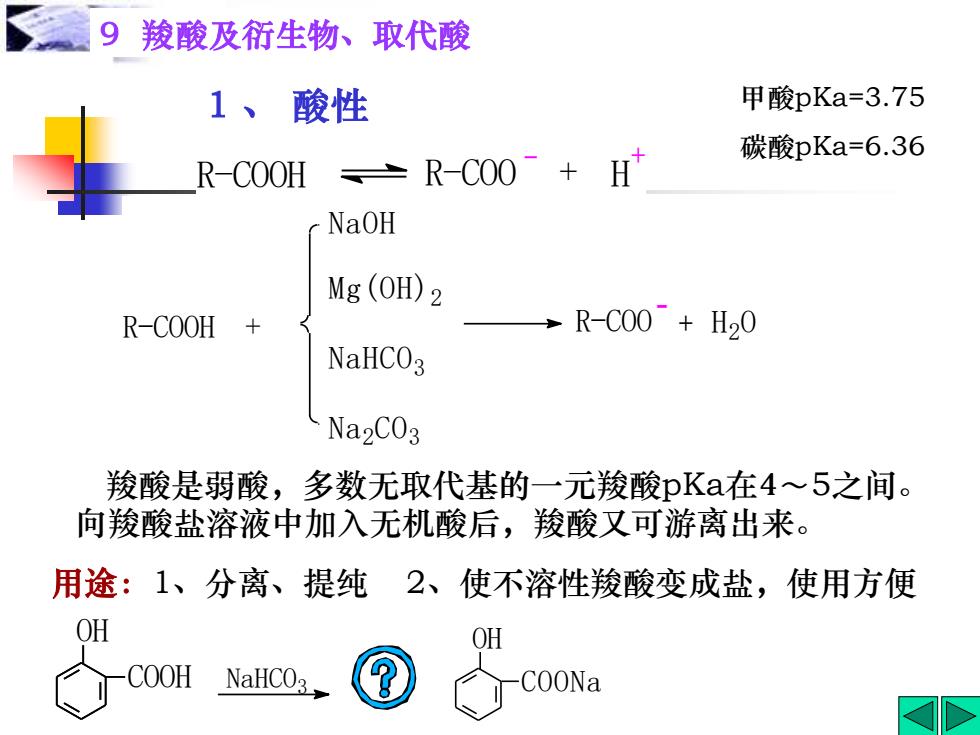
9羧酸及衍生物、取代酸 1、酸性 甲酸pKa=3.75 碳酸pKa=6.36 R-COOH 土 R-COO H NaOH Mg (OH)2 R-COOH R-C00+H20 NaHCO3 Na2CO3 羧酸是弱酸,多数无取代基的一元羧酸pKa在4~5之间。 向羧酸盐溶液中加入无机酸后,羧酸又可游离出来。 用途:1、分离、提纯 2、使不溶性羧酸变成盐,使用方便 OH OH COOH NaHCO3 COONa
1 、 酸性 用途:1、分离、提纯 2、使不溶性羧酸变成盐,使用方便 甲酸pKa=3.75 碳酸pKa=6.36 9 羧酸及衍生物、取代酸 H + R-COOH R-COO + R-COOH + NaOH Mg(OH)2 NaHCO3 Na2 CO3 R-COO + H2 O - COOH OH NaHCO3 COONa OH 羧酸是弱酸,多数无取代基的一元羧酸pKa在4~5之间。 向羧酸盐溶液中加入无机酸后,羧酸又可游离出来

9羧酸及衍生物、取代酸 与羧基直接或间接相连的原子或基团,对羧酸的酸 性有不同程度的影响。 吸电子基团吸电子能力越强;数目越多;离羧基越 近;羧酸的酸性则越强。 C1 H FCH2COOH C1CH2COOH BrCH2COOH ICH2COOH C13CCOOH C12CHCOOH C1CH2COOH CH3CH2CHCOOH CH3CHCH2COOH CH2CH2CH2COOH C1 cl Cl
9 羧酸及衍生物、取代酸 Cl CH2 CH2 CH2 COOH Cl CH3 CHCH2 COOH Cl CH3 CH2 CHCOOH Cl3 CCOOH Cl2 CHCOOH ClCH2 COOH FCH2 COOH ClCH2 COOH BrCH2 COOH ICH2 COOH 与羧基直接或间接相连的原子或基团,对羧酸的酸 性有不同程度的影响。 吸电子基团吸电子能力越强;数目越多;离羧基越 近;羧酸的酸性则越强。 R CH C OH O R CH C OH O Cl H

9羧酸及衍生物、取代酸 饱和一元羧酸中,甲酸的酸性最强。 二元羧酸中,乙二酸的酸性最强。乙二酸、丙二 酸的pKa1都比一元羧酸的小得多。 COOH C00H> H-C-OH CHCOOH CH3CH2COOH 1. 8 CH2CH2COOH 2. HCOOH 3.HOOCCH2CHCOOH C1 4. H2C03 5.HOOCCH2CH2COOH 酸性由大到小的顺序为:3>2>5>1>4
酸性由大到小的顺序为: 3 > 2 > 5 >1 > 4 饱和一元羧酸中,甲酸的酸性最强。 二元羧酸中, 乙二酸的酸性最强。乙二酸、丙二 酸的pKa1都比一元羧酸的小得多。 COOH COOH H-C-OH O CH3 COOH CH3 CH2 COOH 9 羧酸及衍生物、取代酸 CH3 CH2 COOH HCOOH HOOCCH2 CHCOOH Cl H2 CO3 HOOCCH2 CH2 COOH 1 2 3 4 5