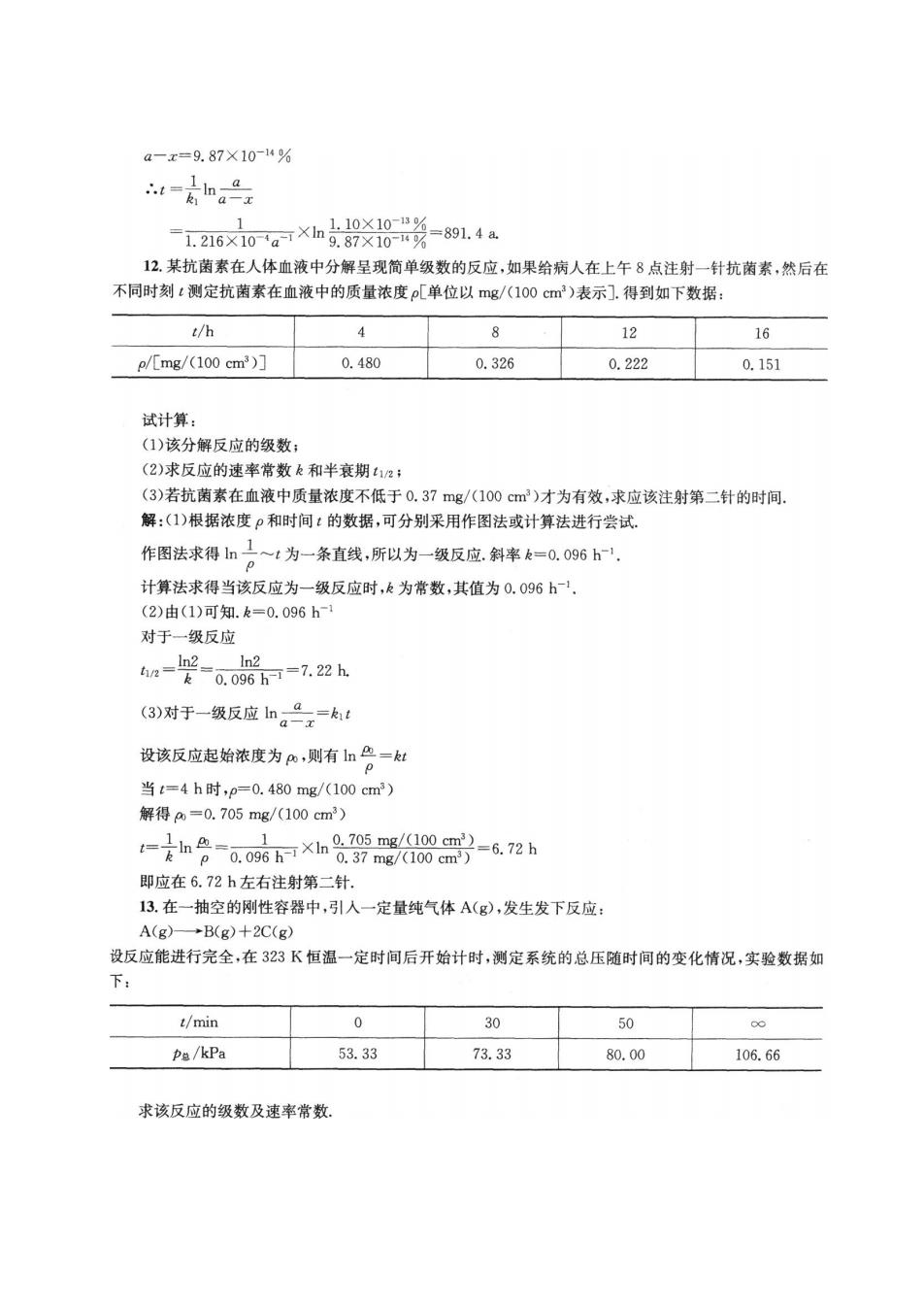
a-x=9.87×10-14% 4-n。品 -126X0aXh8918-91.4 12.某抗菌素在人体血液中分解呈现简单级数的反应,如果给病人在上午8点注射一针抗菌素,然后在 不同时刻t测定抗菌素在血液中的质量浓度p[单位以mg/(100cm)表示].得到如下数据: t/h 4 8 12 16 p/[mg/(100cmr2)] 0.480 0.326 0.222 0.151 试计算: (1)该分解反应的级数: (2)求反应的速率常数飞和半衰期12 (3)若抗菌素在血液中质量浓度不低于0.37mg/(100cm)才为有效,求应该注射第二针的时间. 解:(I)根据浓度P和时间:的数据,可分别采用作图法或计算法进行尝试. 作图法求得h二~1为一条直线,所以为一级反应斜率k=0.096. 计算法求得当该反应为一级反应时,k为常数,其值为0.096h. (2)由(1)可知.k=0.096h- 对于一级反应 n=-o08=1.2h (3)对于一级反应ln。日x= 设该反应起始浓度为,则有1血。=虹 当t=4h时,p=0.480mg/(100cm3) 解得o=0.705mg/(100cm3) =h-0.090-6.72h 即应在6.72h左右注射第二针. 13.在一抽空的刚性容器中,引人一定量纯气体A(g),发生发下反应: A(g)→B(g)+2C(g) 设反应能进行完全,在323K恒温一定时间后开始计时,测定系统的总压随时间的变化情况,实验数据如 下: t/min 0 30 50 Pa/kPa 53.33 73.33 80.00 106.66 求该反应的级数及速率常数
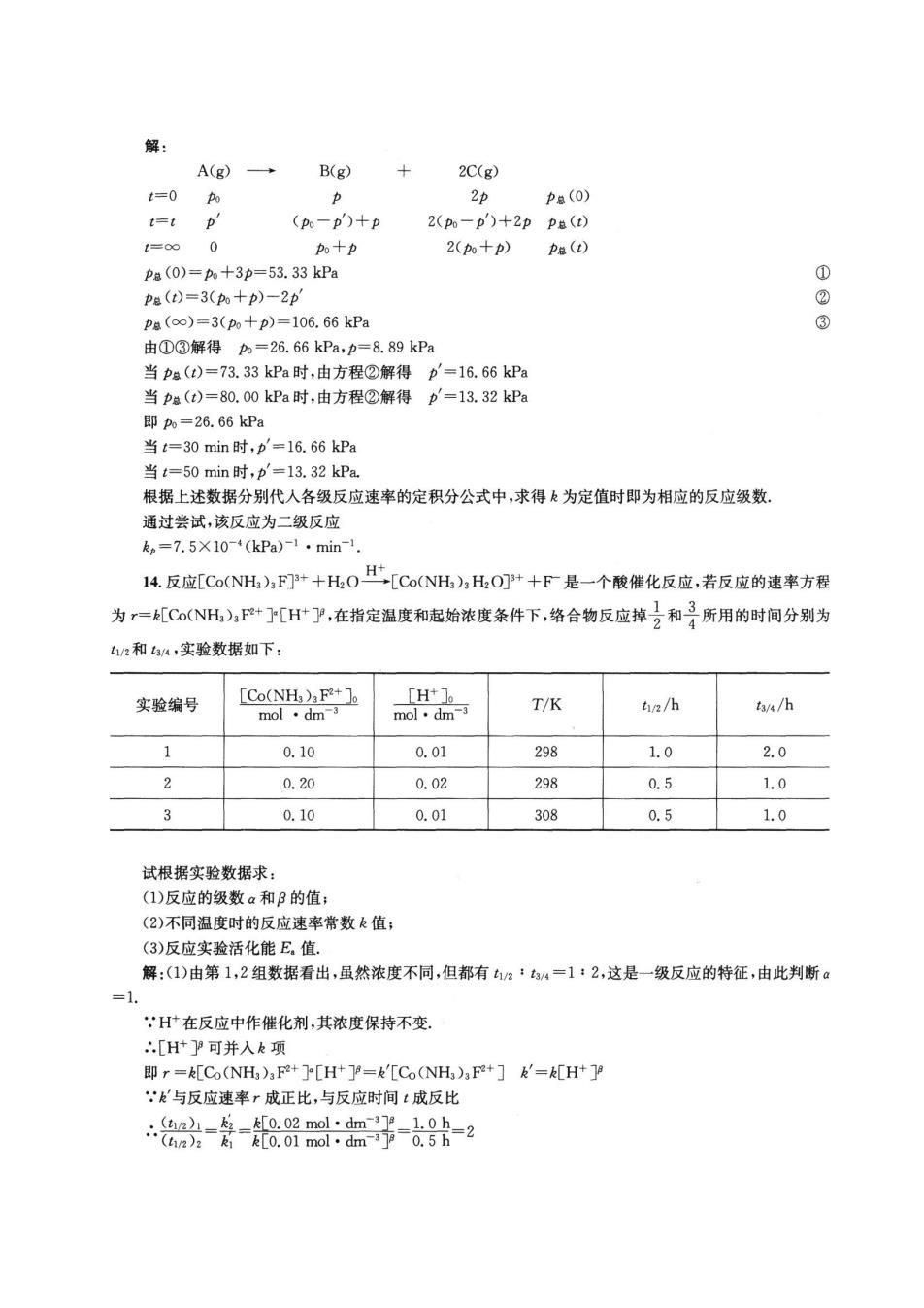
解: A(g)→ B(g) 2C(g) =0 Pa(0) t=t D' (一b')+p 2(-p')+2pp卷(t) 0十p 2(0+p) Pa(t) Pa(0)=+3p=53.33kP Pa()=3(+p)-2p pa(c∞)=3(m+p)=106.66kPa 由①③解得b=26.66kPa.b=8.89kPa 当()=73.3kP时,由方程②解得 p=1666kP 当pa(t)=80.00kPa时,由方程②解得p=13.32kP 即o=26.66kPa 当t=30min时,b'=16.66kPa 当=50min时,p=13.32kP 根据上述数据分别代入各级反应速率的定积分公式中,求得k为定值时即为相应的反应级数。 通过尝试,该反应为二级反应 k。=7.5X10-4(kPa)1·min-1 14.反应[Co(NH),FP+0[Co(NH,HOP+F是一个酸催化反应,若反应的速率方程 为r=[Co(NH)F+[H]P,在指定温度和起始浓度条件下,络合物反应掉2和所用的时间分别为 h2和44,实验数据如下 实验编号 T/K hina/h /h 0.10 0.01 298 1.0 2.0 2 0.20 0.02 298 0.5 1.0 0.10 0.01 308 0.5 1.0 试根据实验数据求 (1)反应的级数a和B的值: (2)不同温度时的反应速率常数k值: (3)反应实验活化能E值 解:(1)由第1,2组数据看出,虽然浓度不同,但都有2·4=12,这是一级反应的特征,由此判断© :H在反应中作催化剂,其浓度保持不变 [H可并入k项 r=A[Co(NH)F+][H'Y=&[Co(NH)F+]&=A[H+ 与反应速率r成正比,与反应时间:成反比

∴8-1 (2)r=k'[Co(NH,),F+]k=k[H+] 对于一级反应6:-兴 ∴当T=298K时 In2 加= 当T=308K时 kn器]o od-1说3mr加h (3)E=R是X()》 =52.89k·molr 15.当有k存在作为催化剂时,氯苯(CH,C)与C在CS()溶液中发生如下的平行反应(均为二级 反应): o-C.H.Ck+HCl CHC+Ca起,b-CH,Ce+HC 没在温度和的浓度 一定时,CHC与C在CS(D溶液中的起始浓度均为0.5mol·dm,30min后, 有15%的CHC转变为o一CHC,有25%的CHC转变为p一CHC.试计算两个速率常数和 k. 解:对于两个都是二级反应的平行反应 像-吾 ① -密=%+e)a- ③ 由0得会-吾影=06 dr 由②得a=(+地 作定积分 。当=a+6地 得aa一司=+6” x=0.5mol,dm3×(15%+25%)=0.2mol·dm3 a=0.5 mol dm,t=30 min 代人(4)中,得k1十k=0.044 ⑤ 将③⑤连立解得 /k=0.0167dm·mol1·min {k2=0.0278dm3·mol1·min-l

16有正,逆反应均为一-级的对鳞反应:D-R.R.RCB急L一RRR,CB,正,逆反应的半衰期均为 2=l0min若起始时D一R:R.RsCBr的物质的量为1mol,试计算在10min后,生成L一RjR:RCBr的 解:正逆反应半衰期相同 k1=k-1=k 对于一级反应 对峙反应 r==-r=1(a-x)-k-1x ∴-k(a-2x)=0.0693×(1-2x) 12=0.0693d山 作定积分2z=00693d山 得x=0.375m0l 即10min后,生成L-R.的量为Q.375mol 17.某反应在300K时进行,完成40%需时24min如果保持其他条件不变,在340K时进行,同样完 成40%,需时6.4min,求该反应的实验活化能. 解:初始浓度和反应程度都相同 .kit=k:t: 名-4-4鼎=85 E=Rn会X(7 -834JK-1·mrXh375×8x3K =28.02kJ·mo1 18.N2O(g)的热分解反应为2N:0(g) 一2N,(g)+0(g),在一定温度下,反应的半衰期与初始压力 成反比.在970K时,0(g)的初始压力为39.2kPa,测得半衰期为1529s:在1030K时,0(g)的初始压 力为48.0kPa,测得半衰期为212s (1)判断该反应的级数: (2)计算两个温度下的速率常数 (3)求反应的实验活化能: (4)在1030K,当NO(g)的初始压力为53.3kPa时,计算总压达到64.0kPa所需的时间 解:(1)反应的半衰期与初始压力成反比,符合二级反应的特点 “该反应为二级反应。 (2)对于二级反位4a。 当T=970K时