
正题45 1.半纤维素(hemicellulose) 分钟 由多聚戊糖(多聚木糖,多聚阿拉伯糖)和多聚己糖(多聚半乳 糖,多聚甘露糖)形成的混合物。 (这里强调混合物的概念、不 均一性) 3.肽聚糖 3.糖胺聚糖 必 第四节结合糖 一、糖蛋白 糖与多肽或蛋白质以共价键连接成的结合蛋白质,即糖蛋白。以 蛋白质为主体。 糖蛋白普遍存在于生物体组织和体液中,具有重要的生物功能。 1.免疫球蛋白所有免疫球蛋白都是糖蛋白。 2.激素糖蛋白 促性腺激素 3.血浆糖蛋白转铁蛋白 投 4.结缔组织糖蛋白胶原蛋白 5.细胞膜糖蛋白 6.植物凝集素纤维蛋白原 7.酶类如核糖核酸酶 二、糖脂 一个或多个单糖残基与脂类部分结合,称为糖脂(glycolipids)。 不包括磷酸的鞘胺醇的衍生物。 三、蛋白聚糖 用变性方法从软骨中纯化的蛋白聚糖分子量达1.6X106,沉降系 数为16S。在活体内以巨大分子聚集体存在(70S-600S)。 在蛋白聚糖分子结构中, 多肽链位于中间,构成一条主链,称为 核心蛋白,糖胺聚糖分子排列在两侧。 在蛋白聚糖中,强调三种糖肽键: D一木糖与丝氨酸羟基之间形成的一0一糖肽键 N一乙酰葡萄糖胺与天冬酰胺之间形成的一N一糖肽键; N一乙酰半乳糖胺与苏氨酸或丝氨酸羟基之间形成的一0一糖肽 键。 总结5 弄清:粘多糖/粘蛋白,糖胺聚糖/蛋白聚糖/糖蛋白。这里用比累 分钟 较法总结。 粘多糖 又叫糖胺聚糖,是含氮多糖,是长而不分支的多糖链 如透明质酸、硫酸软骨素、肝素等。 如果在粘多糖一定部位上连上若干个肽链,即成为蛋白聚糖。在 的 蛋白聚糖中,糖含量可超过95%。因为具有粘稠性,曾叫粘蛋 白。在蛋白聚糖分子结构中,多肽链位于中间,构成一条主链, 称为核心蛋白,糖胺聚糖分子排列在两侧。 糖蛋白,以蛋白质为主体。下节详细讲
11 正题 45 分钟 1.半纤维素(hemicellulose) 由多聚戊糖(多聚木糖,多聚阿拉伯糖)和多聚己糖(多聚半乳 糖,多聚甘露糖)形成的混合物。(这里强调混合物的概念、不 均一性) 3.肽聚糖 3.糖胺聚糖 第四节 结合糖 一、糖蛋白 糖与多肽或蛋白质以共价键连接成的结合蛋白质,即糖蛋白。以 蛋白质为主体。 糖蛋白普遍存在于生物体组织和体液中,具有重要的生物功能。 1.免疫球蛋白 所有免疫球蛋白都是糖蛋白。 2.激素糖蛋白 促性腺激素 3.血浆糖蛋白 转铁蛋白 4.结缔组织糖蛋白 胶原蛋白 5.细胞膜糖蛋白 6.植物凝集素 纤维蛋白原 7.酶类 如核糖核酸酶 二、糖脂 一个或多个单糖残基与脂类部分结合,称为糖脂(glycolipids)。 不包括磷酸的鞘胺醇的衍生物。 三、蛋白聚糖 用变性方法从软骨中纯化的蛋白聚糖分子量达 1.6X106,沉降系 数为 16S。在活体内以巨大分子聚集体存在(70S-600S)。 在蛋白聚糖分子结构中,多肽链位于中间,构成一条主链,称为 核心蛋白,糖胺聚糖分子排列在两侧。 在蛋白聚糖中,强调三种糖肽键: D-木糖与丝氨酸羟基之间形成的-O-糖肽键; N-乙酰葡萄糖胺与天冬酰胺之间形成的-N-糖肽键; N-乙酰半乳糖胺与苏氨酸或丝氨酸羟基之间形成的-O-糖肽 键。 投 影 投 影 总结 5 分钟 弄清:粘多糖/粘蛋白,糖胺聚糖/蛋白聚糖/糖蛋白。这里用比 较法总结。 粘多糖,又叫糖胺聚糖,是含氮多糖,是长而不分支的多糖链, 如透明质酸、硫酸软骨素、肝素等。 如果在粘多糖一定部位上连上若干个肽链,即成为蛋白聚糖。在 蛋白聚糖中,糖含量可超过 95%。因为具有粘稠性,曾叫粘蛋 白。在蛋白聚糖分子结构中,多肽链位于中间,构成一条主链, 称为核心蛋白,糖胺聚糖分子排列在两侧。 糖蛋白,以蛋白质为主体。下节详细讲。 累 计 学 时 8
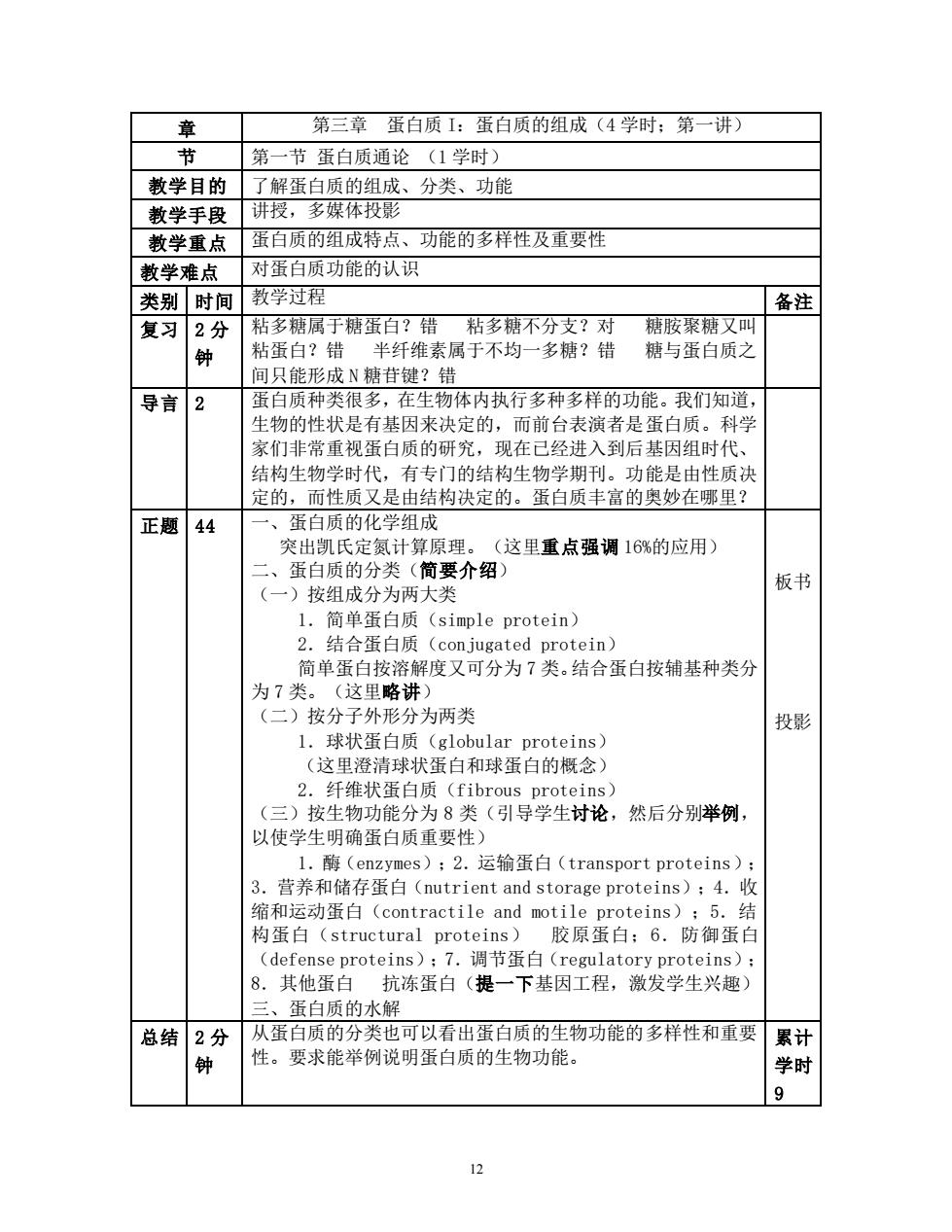
章 第三章蛋白质1:蛋白质的组成(4学时:第一讲) 节 第一节蛋白质通论(1学时) 教学目的 了解蛋白质的组成、分类、功能 教学手段 讲授,多媒体投影 教学重点 蛋白质的组成特点、功能的多样性及重要性 教学难点 对蛋白质功能的认识 类别时间 教学过程 备注 复习2分 粘多糖属于糖蛋白?错粘多糖不分支?对 糖胺聚糖又叫 粘蛋白?错 半纤维素属于不均一多糖?错 糖与蛋白质之 间只能形成N糖苷键?错 导言2 蛋白质种举很多,在生物休内执行多种多样的功能。我门知首 生物的性状是有基因来决定的,而前台表演者是蛋白质。科学 家们非常重视蛋白质的研究,现在已经进入到后基因组时代、 结构生物学时代,有专门的结构生物学期刊。功能是由性质法 定的,而性质又是由结构决定的。蛋白质丰富的奥妙在哪里? 正题44 一、蛋白质的化学组成 室出凯氏定氨十筒原理」 (这里重点强调16%的应用) 蛋白质的分类(简要介绍 (一)按组成分为两大类 板书 结合蛋白质(conjugated protein) 简单蛋白按溶解度又可分为7类。结合蛋白按辅基种类分 为7类。(这里略进) 二)按分子外形分为两类 投影 l.球状蛋白质(globular proteins) (这里澄清球状蛋白和球蛋白的概念) 2. 纤维状蛋白质(fibrous proteins) (三)按生物功能分为8类(引导学生讨论,然后分别举例, 以使学生明确蛋白质重要性) l.酶(enzymes);2.运输蛋白(transport proteins) 3.营养和储存蛋白(utrient and storage proteins):4.收 缩和云动蛋白(contractile and moti1 e proteins):5.结 构蛋白(structural proteins) 胶原蛋白:6.防御蛋白 (defense proteins);7.调节蛋白(regulatory proteins): 8.其他蛋白抗冻蛋白(提一下基因工程,激发学生兴趣) 三、蛋白质的水解 总结 2分 从蛋白质的分类也可以看出蛋白质的生物功能的多样性和重要累计 钟 性。要求能举例说明蛋白质的生物功能 学时 9
12 章 第三章 蛋白质 I:蛋白质的组成(4 学时;第一讲) 节 第一节 蛋白质通论 (1 学时) 教学目的 了解蛋白质的组成、分类、功能 教学手段 讲授,多媒体投影 教学重点 蛋白质的组成特点、功能的多样性及重要性 教学难点 对蛋白质功能的认识 类别 时间 教学过程 备注 复习 2 分 钟 粘多糖属于糖蛋白?错 粘多糖不分支?对 糖胺聚糖又叫 粘蛋白?错 半纤维素属于不均一多糖?错 糖与蛋白质之 间只能形成 N 糖苷键?错 导言 2 蛋白质种类很多,在生物体内执行多种多样的功能。我们知道, 生物的性状是有基因来决定的,而前台表演者是蛋白质。科学 家们非常重视蛋白质的研究,现在已经进入到后基因组时代、 结构生物学时代,有专门的结构生物学期刊。功能是由性质决 定的,而性质又是由结构决定的。蛋白质丰富的奥妙在哪里? 正题 44 一、蛋白质的化学组成 突出凯氏定氮计算原理。(这里重点强调 16%的应用) 二、蛋白质的分类(简要介绍) (一)按组成分为两大类 1.简单蛋白质(simple protein) 2.结合蛋白质(conjugated protein) 简单蛋白按溶解度又可分为 7 类。结合蛋白按辅基种类分 为 7 类。(这里略讲) (二)按分子外形分为两类 1.球状蛋白质(globular proteins) (这里澄清球状蛋白和球蛋白的概念) 2.纤维状蛋白质(fibrous proteins) (三)按生物功能分为 8 类(引导学生讨论,然后分别举例, 以使学生明确蛋白质重要性) 1.酶(enzymes);2.运输蛋白(transport proteins); 3.营养和储存蛋白(nutrient and storage proteins);4.收 缩和运动蛋白(contractile and motile proteins);5.结 构蛋白(structural proteins) 胶原蛋白;6.防御蛋白 (defense proteins);7.调节蛋白(regulatory proteins); 8.其他蛋白 抗冻蛋白(提一下基因工程,激发学生兴趣) 三、蛋白质的水解 板书 投影 总结 2 分 钟 从蛋白质的分类也可以看出蛋白质的生物功能的多样性和重要 性。要求能举例说明蛋白质的生物功能。 累计 学时 9
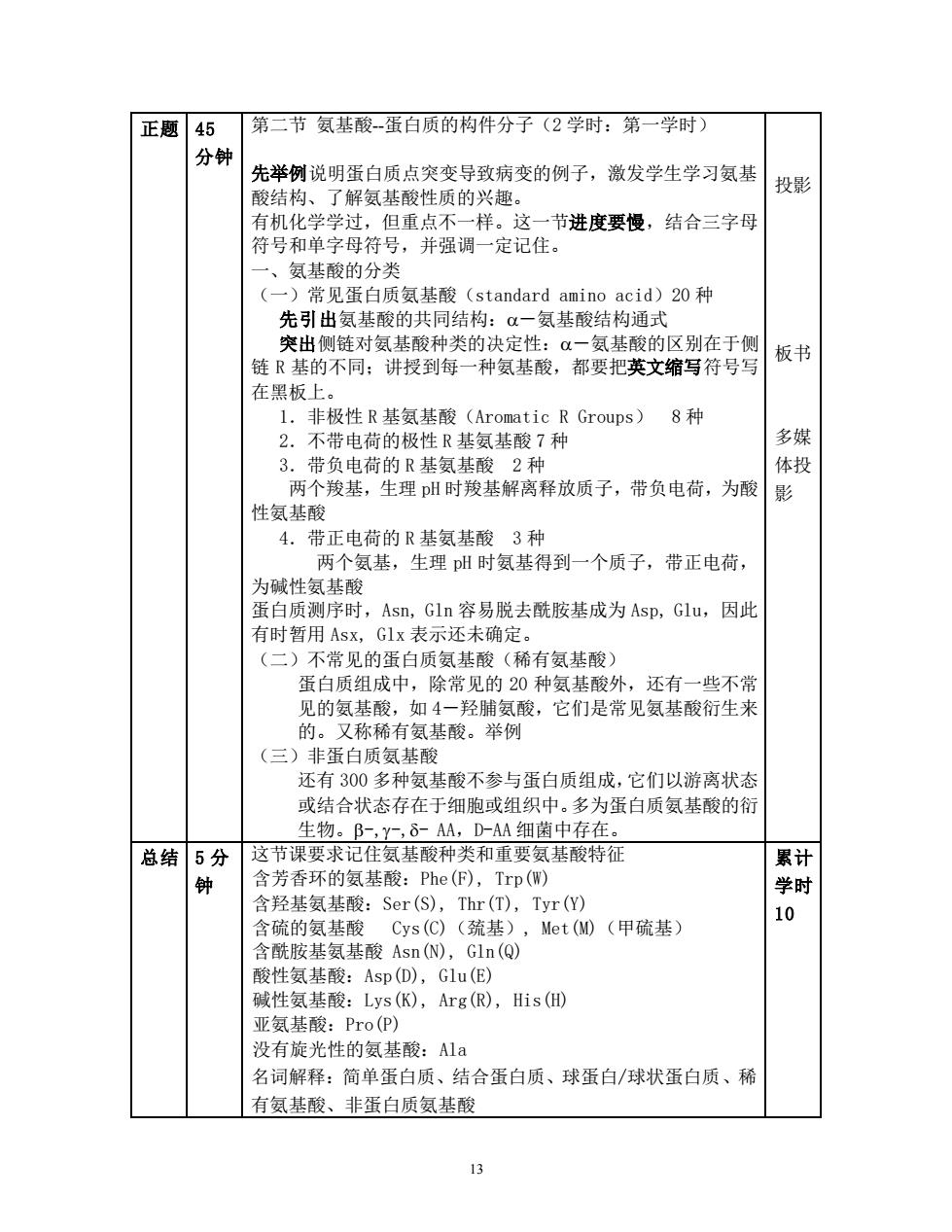
正题45 第二节氨基酸蛋白质的构件分子(2学时:第一学时) 分钟 先举例说明蛋白质点突变导致病变的例子,激发学生学习氨基 酸结构、了解氨基酸性质的兴趣。 投影 有机化学学过,但重点不一样。这一节进度要慢,结合三字母 符号和单字母符号,并强调一定记住。 氨基酸的分类 (一)常见蛋白质氨基酸(standard amino acid)20种 先引出氨基酸的共同结构: α一氨基酸结构通式 突出侧链对氨基酸种类的决定性:α一氨基酸的区别在于侧 链R基的不同:讲授到每一种氨基酸,都要把英文缩写符号写 板书 在里板上。 1.非极性R基氨基酸(Aromatic R Groups) 8种 2.不带电荷的极性R基氨基酸7种 多媒 3.带负电荷的R基氨基酸2种 体投 两 个羧基,生理H时羧基解离释放质子,带负电荷,为酸影 性氨基酸 4.带正电荷的R基氨基酸3种 两个氨基,生理H时氨基得到一个质子,带正电荷, 为碱性氨基酸 蛋白质测序时,Asn,Gln容易脱去酰胺基成为Asp,Glu,因此 有时暂用ASX,Glx表示还未确定。 (二)不常见的蛋白质氨基酸(稀有氨基酸) 蛋白质组成中,除常见的20种氨基酸外,还有一些不常 见的氨基酸 如4 一羟脯氨酸,它们是常见氨基酸衍生 的。又称稀有氨基酸。举例 (三)非蛋白质氨基酸 还有300多种氨基酸不参与蛋白质组成,它们以游离状态 或结合状态存在于细胞或组织中。多为蛋白质氨基酸的衍 生物。B-,Y-,δ-AA,D-AA细菌中存在。 总结5分 这节课要求记住氨基酸种类和重要氨基酸特征 累计 钟 含芳香环的氨基酸:Phe(F),Trp(W) 学时 含羟基氨基酸:Ser(S),Thr(T),Tyr() 含硫的氨基酸 Cys(C)(巯基) Met()(甲硫基) 10 含酰胺基氨基酸Asn(),Gln(Q) 酸性氨基酸:Asp(D),Glu(E) 碱性氨基酸:Lys(K),Arg(R),is( 亚氨基酸:Pro(P) 没有旋光性的氨基酸:A1a 名词解释:简单蛋白质、结合蛋白质、球蛋白/球状蛋白质、稀 有氨基酸、非蛋白质氨基酸 13
13 正题 45 分钟 第二节 氨基酸-蛋白质的构件分子(2 学时:第一学时) 先举例说明蛋白质点突变导致病变的例子,激发学生学习氨基 酸结构、了解氨基酸性质的兴趣。 有机化学学过,但重点不一样。这一节进度要慢,结合三字母 符号和单字母符号,并强调一定记住。 一、氨基酸的分类 (一)常见蛋白质氨基酸(standard amino acid)20 种 先引出氨基酸的共同结构:-氨基酸结构通式 突出侧链对氨基酸种类的决定性:-氨基酸的区别在于侧 链 R 基的不同;讲授到每一种氨基酸,都要把英文缩写符号写 在黑板上。 1.非极性 R 基氨基酸(Aromatic R Groups) 8 种 2.不带电荷的极性 R 基氨基酸 7 种 3.带负电荷的 R 基氨基酸 2 种 两个羧基,生理 pH 时羧基解离释放质子,带负电荷,为酸 性氨基酸 4.带正电荷的 R 基氨基酸 3 种 两个氨基,生理 pH 时氨基得到一个质子,带正电荷, 为碱性氨基酸 蛋白质测序时,Asn, Gln 容易脱去酰胺基成为 Asp, Glu,因此 有时暂用 Asx, Glx 表示还未确定。 (二)不常见的蛋白质氨基酸(稀有氨基酸) 蛋白质组成中,除常见的 20 种氨基酸外,还有一些不常 见的氨基酸,如 4-羟脯氨酸,它们是常见氨基酸衍生来 的。又称稀有氨基酸。举例 (三)非蛋白质氨基酸 还有 300 多种氨基酸不参与蛋白质组成,它们以游离状态 或结合状态存在于细胞或组织中。多为蛋白质氨基酸的衍 生物。-,-,- AA,D-AA 细菌中存在。 投影 板书 多媒 体投 影 总结 5 分 钟 这节课要求记住氨基酸种类和重要氨基酸特征 含芳香环的氨基酸:Phe(F), Trp(W) 含羟基氨基酸:Ser(S), Thr(T), Tyr(Y) 含硫的氨基酸 Cys(C)(巯基), Met(M)(甲硫基) 含酰胺基氨基酸 Asn(N), Gln(Q) 酸性氨基酸:Asp(D), Glu(E) 碱性氨基酸:Lys(K), Arg(R), His(H) 亚氨基酸:Pro(P) 没有旋光性的氨基酸:Ala 名词解释:简单蛋白质、结合蛋白质、球蛋白/球状蛋白质、稀 有氨基酸、非蛋白质氨基酸 累计 学时 10

章 第三章蛋白质1:蛋白质的组成(4学时,第二讲) 第二节氨基酸-蛋白质的构件分子(2学时:第二学时) 教学目的 了解氨基酸的化学性质及分析方法 教学手段 讲授,多媒体投影 教学重点 氨基酸的等电点、桑格反应、Edman降解 教学难点 PI的来历 类别过程 教学过程 备注 复习 5分 默写20种氨基酸三字母符号和单字母符号(请几个同学上讲台 写) 导言5分 上节课我们已经知道氨基酸既有共性又有特性。它们的特性是 钟 由侧链差别造成的。这节课来分析一下它们的性质和特色反应 然后再介绍如何根据氨基酸的特性进行分离分析。 正题40 氨基酸的酸碱化学 氨基酸具有特征滴定曲线 这里是一个难点,要动态介绍滴定图,和同学一起分析 pK':解离常数K’代表氨基酸羧基解离情况。pK' 等于羧基 板书 解离一半时、即[R]=[R]时的pH值。解离常数K2'代表氨基 绘图 酸氨基解离情况。pK2'等于氨基解离一半时,即[R]=[R]时 的pH值。 等电点:氨基酸所带正电荷数与负电荷数相等时(净电荷为零 时)的溶液pH值,称为等电点(pI) 投影 公式推导:pI=1/2(pK:'+pK') 三、氨基酸的重要化学性质 (一)桑格反应(sanger reaction) 桑格试剂:2,4-二硝基氟苯(2,4-dinitrofluorobenzene DNFB) 生成2,4-二硝基苯基氨基酸(黄色) α一氨基参加的反应,常用于鉴定多肽链氨基末端氨基酸。 (二)艾德曼反应(Edman reaction) 式剂.求异点氨酸(Pheny1 isothioc yanate,PITC) α一氨基参加的反应,常用于鉴定多肽链氨基末端AA。 (三)茚三酮反应(有机化学学过,略讲) (四)巯基的反应(重点介绍) 四、氨基酸的光学活性和光谱性质 Tyr,Phe,Trp苯环、共轭双键近紫外区光吸收(A2m) A=εCL这里突出紫外法测定蛋白质浓度的原理。 小结 2分 讨论题:为什么用紫外法能测定蛋白质含量 累计 钟 氨基酸等电点,pK1,pK2 11
14 章 第三章 蛋白质 I:蛋白质的组成(4 学时,第二讲) 节 第二节 氨基酸-蛋白质的构件分子(2 学时:第二学时) 教学目的 了解氨基酸的化学性质及分析方法 教学手段 讲授,多媒体投影 教学重点 氨基酸的等电点、桑格反应、Edman 降解 教学难点 PI 的来历 类别 过程 教学过程 备注 复习 5 分 默写 20 种氨基酸三字母符号和单字母符号(请几个同学上讲台 写) 导言 5 分 钟 上节课我们已经知道氨基酸既有共性又有特性。它们的特性是 由侧链差别造成的。这节课来分析一下它们的性质和特色反应, 然后再介绍如何根据氨基酸的特性进行分离分析。 正题 40 二、氨基酸的酸碱化学 氨基酸具有特征滴定曲线 这里是一个难点,要动态介绍滴定图,和同学一起分析 pK’:解离常数 K1’代表氨基酸羧基解离情况。pK1’等于羧基 解离一半时、即[R0 ]=[R- ]时的 pH 值。解离常数 K2’代表氨基 酸氨基解离情况。pK2’等于氨基解离一半时,即[R0 ]=[R+ ]时 的 pH 值。 等电点:氨基酸所带正电荷数与负电荷数相等时(净电荷为零 时)的溶液 pH 值,称为等电点(pI)。 公式推导:pI=1/2 (pK1’+pK2’) 三、氨基酸的重要化学性质 (一)桑格反应(sanger reaction) 桑格试剂:2,4-二硝基氟苯(2,4-dinitrofluorobenzene, DNFB) 生成 2,4-二硝基苯基氨基酸(黄色) -氨基参加的反应,常用于鉴定多肽链氨基末端氨基酸。 (二)艾德曼反应(Edman reaction) 试剂:苯异硫氰酸(Phenylisothiocyanate, PITC) -氨基参加的反应,常用于鉴定多肽链氨基末端 AA。 (三)茚三酮反应(有机化学学过,略讲) (四)巯基的反应(重点介绍) 四、氨基酸的光学活性和光谱性质 Tyr, Phe, Trp 苯环、共轭双键 近紫外区光吸收(A280) A=CL 这里突出紫外法测定蛋白质浓度的原理。 板书 绘图 投影 小结 2 分 钟 讨论题:为什么用紫外法能测定蛋白质含量? 氨基酸等电点,pK1,pK2 累计 11

正题45 第三节氨基酸的分离分析(1学时) 分钟 以下内容涉及实验方法,要结合绘图说明,重点是技术原理。 分配柱层析(Partition Chromatography) 分配原理、分配系数、固定相、流动相 板书 二、 滤纸层析(Filter-paper Chromatography) 固定相、流动相、RF值 三、薄层层析(Thin-layer Chromatography)略讲 四、离子交换柱层析(Ion-exchange Column Chromatography 离子交换树脂(重点介绍) 带酸性基团、能解离出质子,与溶液中阳离子发生交换的叫 投影 阳离子交换树脂。-S0H(强酸型)、一C00H(弱酸型) 带正电荷的AA与阳离子交换树脂结合力强。 带碱性基团、能解离出OH、可与溶液中阴离子发生交换的 叫阴离子交换树脂。一N(CL)OH(强碱型)、-NH,OH(弱碱型) 带负电荷的AM与阴离子交换树脂结合力强 强调:洗出顺序主要取决于氨基酸与离子交换树脂静电吸 引,其次是氨基酸侧链与树脂基质的疏水相互作用。 五、气相色谱(gas-liquid chromatography) 气相色谱仪 流动相为气体。又叫气一液色谱,基于分配原理。 优点:微量、快速 六、高效液相色谱(high performance liquid chromatography,HPLC) 溶剂系统为高压 优点:快速、灵敏、高效 总结5分 讨论题:阳离子交换柱,p3时,中性AA、酸性AA、碱性AA,累计 钟 哪一种先被洗脱下来。为什么? 学时 分配柱层析中,填充物就是固定相(错) 分配柱层析中,固定相是指填充物吸附的一层不会流动的结合 12 水。(对)。滤纸层析基于分配原理(对)一定条件下,某AA 的Rf值为恒定的(对) 名词解释:HPLC、阳离子交换剂、分配系数、Rf
15 正题 45 分钟 第三节 氨基酸的分离分析(1 学时) 以下内容涉及实验方法,要结合绘图说明,重点是技术原理。 一、分配柱层析(Partition Chromatography) 分配原理、分配系数、固定相、流动相 二、滤纸层析(Filter-paper Chromatography) 固定相、流动相、Rf 值 三、薄层层析(Thin-layer Chromatography)略讲 四、离子交换柱层析(Ion-exchange Column Chromatography) 离子交换树脂(重点介绍) 带酸性基团、能解离出质子,与溶液中阳离子发生交换的叫 阳离子交换树脂。-SO3H(强酸型)、-COOH(弱酸型) 带正电荷的 AA 与阳离子交换树脂结合力强。 带碱性基团、能解离出 OH-、可与溶液中阴离子发生交换的 叫阴离子交换树脂。-N(CH3)OH(强碱型)、-NH3OH(弱碱型) 带负电荷的 AA 与阴离子交换树脂结合力强。 强调:洗出顺序主要取决于氨基酸与离子交换树脂静电吸 引,其次是氨基酸侧链与树脂基质的疏水相互作用。 五、气相色谱(gas-liquid chromatography) 气相色谱仪 流动相为气体。又叫气-液色谱,基于分配原理。 优点:微量、快速 六 、 高 效 液 相 色 谱 ( high performance liquid chromatography,HPLC) 溶剂系统为高压 优点:快速、灵敏、高效 板书 投影 总结 5 分 钟 讨论题:阳离子交换柱,pH=3 时,中性 AA、酸性 AA、碱性 AA, 哪一种先被洗脱下来。为什么? 分配柱层析中,填充物就是固定相(错) 分配柱层析中,固定相是指填充物吸附的一层不会流动的结合 水。(对)。滤纸层析基于分配原理(对)一定条件下,某 AA 的 Rf 值为恒定的(对)。 名词解释:HPLC、阳离子交换剂、分配系数、Rf 累计 学时 12