
综合考虑这些结构数据和其它研究结果,人们构建出SERCA Ca+泵的详细机制(图 13.5)。 1.催化周期起始是酶结合了两个Ca+离子,但没有磷酸化。反应前没有结合Ca2+的酶 称为E1,结合了Ca+的结构称为El-(Ca2+)2。这种构型的SERCA酶能够交换Ca2+, 但是只局限于膜的细胞质这一面。 2.E1结构的酶蛋白与ATP结合。由于N,P,和A结构域处于结合ATP位,点附近, 这些结构域发生结构重排。但是酶蛋白的跨膜结构域没有结构变化。C+被俘获于 酶蛋白分子内。 3.磷酰基从ATP转移到Asp351 4.释放ADP,酶蛋白的结构(包括跨膜结构域)又发生变化。新的构型称为E2或E2-P (如果是磷酸化状态)。E1和E2之间的结构转换有时称为构型翻转(eversion)。E2-P 构型的酶蛋白,其Ca2+离子结合位点遭到破坏,Ca+离子被释放到膜的另一面,达 到了运输Ca2+离子的目的。其构型见图13.4。 5.磷酰天冬氨酸发生水解,释放无机磷酸。 6.随着无机磷酸的释放,E2构型中各种结构域之间的相互作用也不能维持,酶蛋白质 又发生翻转,恢复E1结构。 在细胞质面结合两个Ca2+离子,完成了SERCA运输Ca+离子的一个周期。这种运输机 制适用于其它P.类ATPase。例如,Na-K+ATPase是四聚体,其亚基与SERCA 同源,含有域ASp351类似的同源天冬氨酸。B亚基不直接参与离子运输。离子的运输机制 与图13.5描述的机制相似。E1构型结合胞内3个Na离子,E2构型结合细胞外2个K+。 洋地黄(digitalis)阻止Na+-Kt泵脱磷酸化,特异抑制Na+-K泵活性 植物来源的一些甾体化合物是很强的Na.K*泵抑制剂(Ki≈I0nM)。毛地黄毒苷 (digitoxigenin)和哇巴因(ouabain)属于这类抑制剂。这些化合物对心脏影响强烈,称为强 心类固醇(图13.6)。在膜的胞外面使用这些化合物,它们能抑制E2-P型的Na-K+泵脱 磷酸。 洋地黄是从植物的干叶子中获取的强心胆固醇类混合物。这种化合物能增强心肌的收缩 力,是治疗充血性心力衰竭(congestive heart failure)的选择药物。洋地黄抑制Na+-Kt泵 使细胞内Na浓度较高。Na+浓度梯度降低使Na-Ca+交换器外排Ca+速度降低。结果 细胞内C+浓度增加,促进心肌收缩。有趣的是,在人们发现洋地黄抑制Na-K+泵之前, 人们已经有很长时间都在有效地利用详地黄。I785年,英国医生William Withering听说一 位Shropshire的老妇人用植物千叶子抽提液治疗“积水”疾病(就是今天的充血性心力衰竭)。 Withering首次对植物千叶子抽提液治疗充血性心力衰竭进行科学研究,证实其治疗效果。 毛地黄是获取洋地黄的原料。洋地黄是使用最广泛的药物之一
综合考虑这些结构数据和其它研究结果,人们构建出 SERCA Ca 2+泵的详细机制(图 13.5)。 1. 催化周期起始是酶结合了两个 Ca 2+离子,但没有磷酸化。反应前没有结合 Ca 2+的酶 称为 E1,结合了 Ca 2+的结构称为 E1-(Ca 2+ )2。这种构型的 SERCA 酶能够交换 Ca 2+, 但是只局限于膜的细胞质这一面。 2. E1 结构的酶蛋白与 ATP 结合。由于 N,P,和 A 结构域处于结合 ATP 位点附近, 这些结构域发生结构重排。但是酶蛋白的跨膜结构域没有结构变化。Ca 2+被俘获于 酶蛋白分子内。 3. 磷酰基从 ATP 转移到 Asp351. 4. 释放 ADP,酶蛋白的结构(包括跨膜结构域)又发生变化。新的构型称为 E2或 E2-P (如果是磷酸化状态)。E1和 E2之间的结构转换有时称为构型翻转(eversion)。E2-P 构型的酶蛋白,其 Ca 2+离子结合位点遭到破坏,Ca 2+离子被释放到膜的另一面,达 到了运输 Ca 2+离子的目的。其构型见图 13.4。 5. 磷酰天冬氨酸发生水解,释放无机磷酸。 6. 随着无机磷酸的释放,E2构型中各种结构域之间的相互作用也不能维持,酶蛋白质 又发生翻转,恢复 E1结构。 在细胞质面结合两个 Ca 2+离子,完成了 SERCA 运输 Ca 2+离子的一个周期。这种运输机 制适用于其它 P-类 ATPase。例如,Na + - K+ ATPase 是 四聚体,其 亚基与 SERCA 同源,含有域 Asp351 类似的同源天冬氨酸。B 亚基不直接参与离子运输。离子的运输机制 与图 13.5 描述的机制相似。E1 构型结合胞内 3 个 Na +离子,E2 构型结合细胞外 2 个 K+。 洋地黄(digitalis)阻止 Na + - K+ 泵脱磷酸化,特异抑制 Na + - K+ 泵活性 植物来源的一些甾体化合物是很强的 Na + - K+ 泵抑制剂(Ki ≈ 10 nM)。毛地黄毒苷 (digitoxigenin)和哇巴因(ouabain)属于这类抑制剂。这些化合物对心脏影响强烈,称为强 心类固醇(图 13.6)。在膜的胞外面使用这些化合物,它们能抑制 E2-P 型的 Na + - K+ 泵脱 磷酸。 洋地黄是从植物的干叶子中获取的强心胆固醇类混合物。这种化合物能增强心肌的收缩 力,是治疗充血性心力衰竭(congestive heart failure)的选择药物。洋地黄抑制 Na + - K+ 泵 使细胞内 Na + 浓度较高。Na +浓度梯度降低使 Na + - Ca 2+ 交换器外排 Ca 2+ 速度降低。结果 细胞内 Ca 2+ 浓度增加,促进心肌收缩。有趣的是,在人们发现洋地黄抑制 Na + - K+泵之前, 人们已经有很长时间都在有效地利用洋地黄。1785 年,英国医生 William Withering 听说一 位 Shropshire 的老妇人用植物干叶子抽提液治疗“积水”疾病(就是今天的充血性心力衰竭)。 Withering 首次对植物干叶子抽提液治疗充血性心力衰竭进行科学研究,证实其治疗效果。 毛地黄是获取洋地黄的原料。洋地黄是使用最广泛的药物之一

E2-P+H20E2+P1 HO Inhibited by Digitoxigenin cardiotonic steroids n 图13.6毛地黄毒苷。强心类固醇如毛地黄毒苷阻止E2-P脱磷酸,从而抑制Na-K+泵。 P-类ATP进化保守、能执行很多功能 酵母全基因组序列指出有16个蛋白质属于P.类ATPase家族。更详细的序列分析提示, 其中两个蛋白质运输H中,两个蛋白质运输Ca2+,三个蛋白质运输Na*,两个运输金属离子 (如Cu+)。还有5个蛋白质参与头部带有氨基的磷脂运输。这种运输能够将磷脂酰丝氨 酸类磷脂从生物膜的内半面运输到外版面,维持生物膜的不对称性。这5种蛋白质称为翻转 酶(flippase)。令人印象更深刻的是,人基因组编码70种P-类ATPase。.该蛋白家族的所有 成员所采用的机制基本相同。ATP水解提供的能量导致膜蛋白构型转化、驱动生物膜运输。 这种构型转化是由于各种蛋白质特定的天冬氨酸发生磷酸化和去磷酸化诱导产生的。 多重药物抗性显示具有ATP结合域的膜泵家族蛋白的重要性 对人类疾病的研究揭示另一个重要的运输蛋白家族,其蛋白质结构和运输机理与 P-ATPase家族明显不同。培养的肿瘤细胞能够耐受那些起初对细胞毒性很大的药物。这种 细胞有耐药性后,对其他药物也有一定程度的抗性。这种现象叫多重药物抗性。后来发现分 子质量为170kD的膜蛋白质表达及其活性水平与多重药物耐受性密切相关。这种蛋白质是 依赖于ATP的分子泵,能够从细胞内泵出各种大小的小分子。这个膜蛋白称为多重药物抗 性蛋白(MDR)或P糖蛋白。因此,将这种细胞暴露于药物环境中,细胞膜上的MDR泵 能够将细胞内还没有发挥作用的药物泵出细胞。 MDR及其同源蛋白的氨基酸序列分析显示这些蛋白有共同的结构特征(图13.7)。每个 蛋白质有四个结构域:两个结构域跨膜,两个ATP结合cassettes(ABC)与细菌和古生菌 运输蛋白相应的结构城相似。含有这些结构域的运输蛋白称为ABC运输子。从大肠杆菌基 因组鉴定出ABC运输子有79个成员,属于最大的单一家族。人类基因组含有150多种ABC 运输子基因。 Membr ATP. ding domain cassette N ■C Multidrug-resistance protein (MDR) 图I3.7ABC运输子。多重药物抗性蛋白(MRD)是含有两个跨膜域和两个ATP结合域(即 ATP结合盒蛋白ABCs)大家族的代表
图 13.6 毛地黄毒苷。强心类固醇如毛地黄毒苷阻止 E2-P 脱磷酸,从而抑制 Na + - K+ 泵。 P-类 ATP 进化保守、能执行很多功能 酵母全基因组序列指出有 16 个蛋白质属于 P-类 ATPase 家族。更详细的序列分析提示, 其中两个蛋白质运输 H+,两个蛋白质运输 Ca 2+,三个蛋白质运输 Na +,两个运输金属离子 (如 Cu 2+ )。还有 5 个蛋白质参与头部带有氨基的磷脂运输。这种运输能够将磷脂酰丝氨 酸类磷脂从生物膜的内半面运输到外版面,维持生物膜的不对称性。这 5 种蛋白质称为翻转 酶(flippase)。令人印象更深刻的是,人基因组编码 70 种 P-类 ATPase。该蛋白家族的所有 成员所采用的机制基本相同。ATP 水解提供的能量导致膜蛋白构型转化、驱动生物膜运输。 这种构型转化是由于各种蛋白质特定的天冬氨酸发生磷酸化和去磷酸化诱导产生的。 多重药物抗性显示具有 ATP 结合域的膜泵家族蛋白的重要性 对人类疾病的研究揭示另一个重要的运输蛋白家族,其蛋白质结构和运输机理与 P-ATPase 家族明显不同。培养的肿瘤细胞能够耐受那些起初对细胞毒性很大的药物。这种 细胞有耐药性后,对其他药物也有一定程度的抗性。这种现象叫多重药物抗性。后来发现分 子质量为 170 kD 的膜蛋白质表达及其活性水平与多重药物耐受性密切相关。这种蛋白质是 依赖于 ATP 的分子泵,能够从细胞内泵出各种大小的小分子。这个膜蛋白称为多重药物抗 性蛋白(MDR)或 P-糖蛋白。因此,将这种细胞暴露于药物环境中,细胞膜上的 MDR 泵 能够将细胞内还没有发挥作用的药物泵出细胞。 MDR 及其同源蛋白的氨基酸序列分析显示这些蛋白有共同的结构特征(图 13.7)。每个 蛋白质有四个结构域:两个结构域跨膜,两个 ATP-结合 cassettes(ABC)与细菌和古生菌 运输蛋白相应的结构域相似。含有这些结构域的运输蛋白称为 ABC 运输子。从大肠杆菌基 因组鉴定出 ABC 运输子有 79 个成员,属于最大的单一家族。人类基因组含有 150 多种 ABC 运输子基因。 图 13.7 ABC 运输子。多重药物抗性蛋白(MRD)是含有两个跨膜域和两个 ATP 结合域(即 ATP 结合盒蛋白 ABCs)大家族的代表
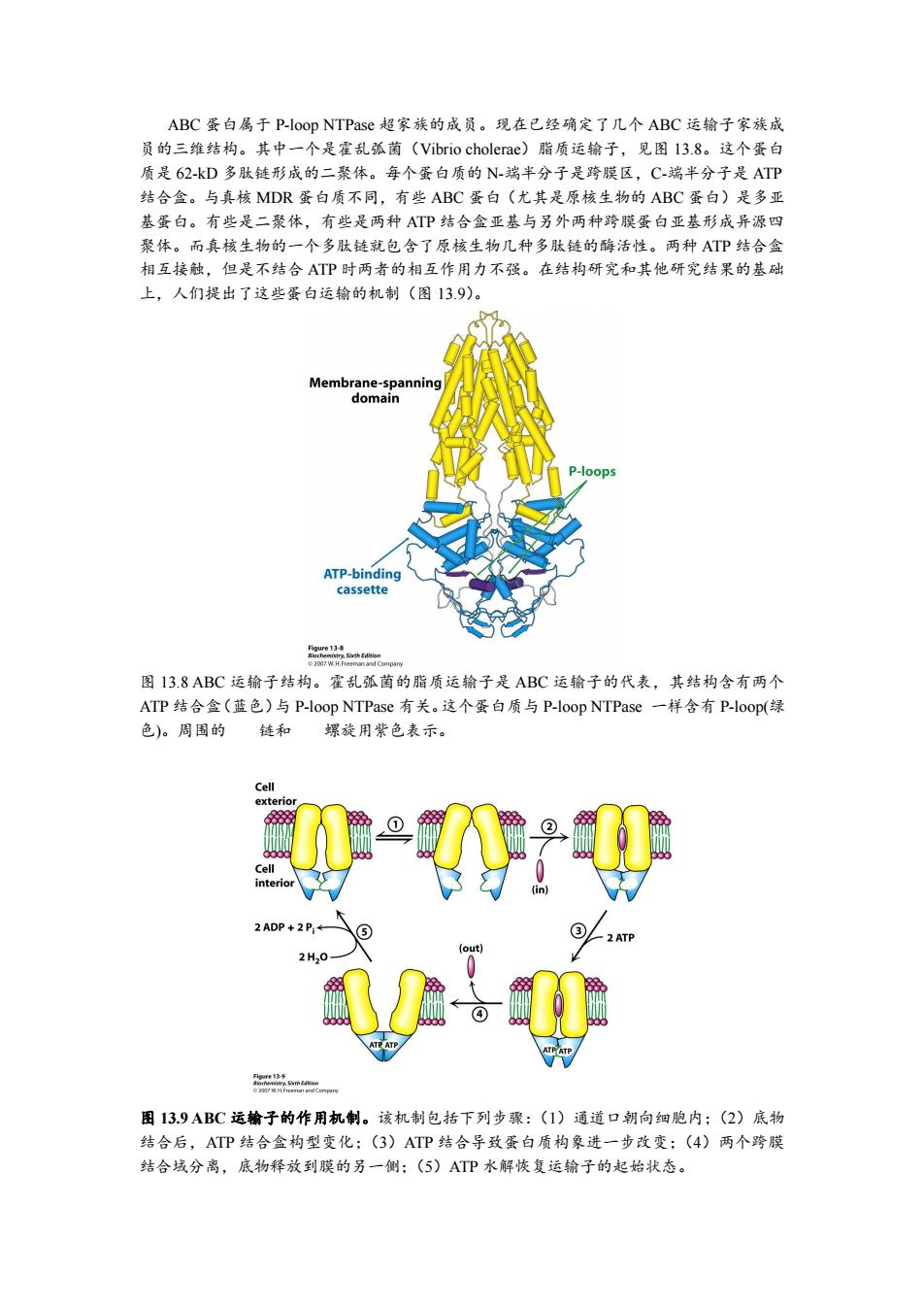
ABC蛋白属于P-loop NTPase超家族的成员。现在已经确定了几个ABC运输子家族成 员的三维结构。其中一个是霍乱孤菌(Vibrio cholerae)脂质运输子,见图l3.8。这个蛋白 质是62-kD多肽链形成的二聚体。每个蛋白质的N-端半分子是跨膜区,C端半分子是ATP 结合盒。与真核MDR蛋白质不同,有些ABC蛋白(尤其是原核生物的ABC蛋白)是多亚 基蛋白。有些是二聚体,有些是两种ATP结合盒亚基与另外两种跨膜蛋白亚基形成异源四 聚体。而真核生物的一个多肽链就包含了原核生物几种多肽链的酶活性。两种ATP结合盒 相互接触,但是不结合ATP时两者的相互作用力不强。在结构研究和其他研究结果的基础 上,人们提出了这些蛋白运输的机制(图13.9)。 Membrane-spanning domain P-loops ATP-binding cassette 图13.8ABC运输子结构。霍乱孤菌的脂质运输子是ABC运输子的代表,其结构含有两个 ATP结合盒(蓝色)与P-loop NTPase有关。这个蛋白质与P-loop NTPase一样含有P-loop(绿 色)。周围的链和 螺旋用紫色表示。 Cell exterior ② Cell interior (in) 2ADP+2P,← (⑤ ③ -2 ATP (out) 2H20 图13.9ABC运输子的作用机制。该机制包括下列步骤:(1)通道口朝向细胞内:(2)底物 结合后,ATP结合盒构型变化:(3)ATP结合导致蛋白质构象进一步改变;(4)两个跨膜 结合域分离,底物释放到膜的另一侧:(5)ATP水解恢复运输子的起始状态
ABC 蛋白属于 P-loop NTPase 超家族的成员。现在已经确定了几个 ABC 运输子家族成 员的三维结构。其中一个是霍乱弧菌(Vibrio cholerae)脂质运输子,见图 13.8。这个蛋白 质是 62-kD 多肽链形成的二聚体。每个蛋白质的 N-端半分子是跨膜区,C-端半分子是 ATP 结合盒。与真核 MDR 蛋白质不同,有些 ABC 蛋白(尤其是原核生物的 ABC 蛋白)是多亚 基蛋白。有些是二聚体,有些是两种 ATP 结合盒亚基与另外两种跨膜蛋白亚基形成异源四 聚体。而真核生物的一个多肽链就包含了原核生物几种多肽链的酶活性。两种 ATP 结合盒 相互接触,但是不结合 ATP 时两者的相互作用力不强。在结构研究和其他研究结果的基础 上,人们提出了这些蛋白运输的机制(图 13.9)。 图 13.8 ABC 运输子结构。霍乱弧菌的脂质运输子是 ABC 运输子的代表,其结构含有两个 ATP 结合盒(蓝色)与 P-loop NTPase 有关。这个蛋白质与 P-loop NTPase 一样含有 P-loop(绿 色)。周围的 链和 螺旋用紫色表示。 图 13.9 ABC 运输子的作用机制。该机制包括下列步骤:(1)通道口朝向细胞内;(2)底物 结合后,ATP 结合盒构型变化;(3)ATP 结合导致蛋白质构象进一步改变;(4)两个跨膜 结合域分离,底物释放到膜的另一侧;(5)ATP 水解恢复运输子的起始状态
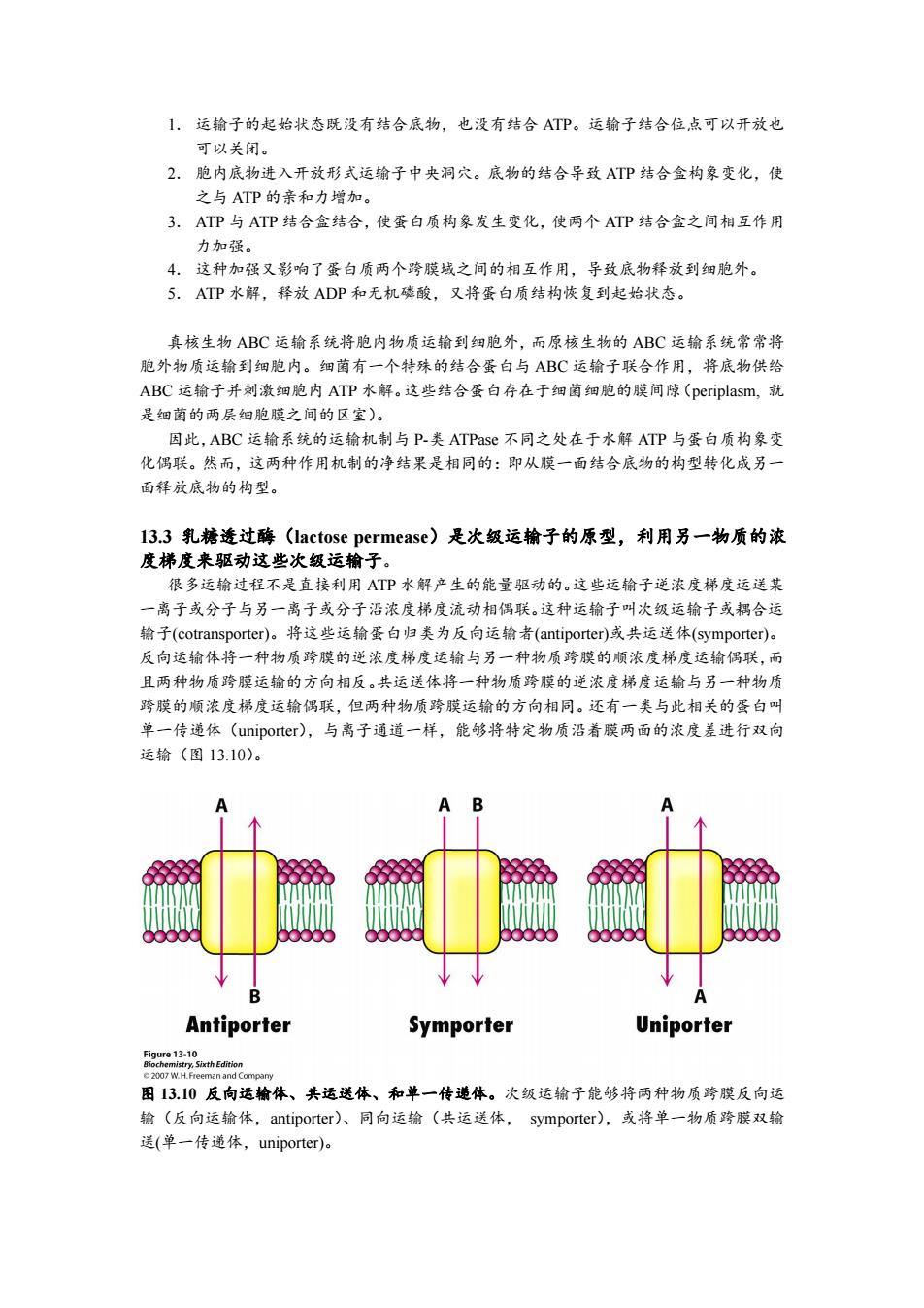
1.运输子的起始状态既没有结合底物,也没有结合ATP。运输子结合位点可以开放也 可以关闭。 2.胞内底物进入开放形式运输子中央洞穴。底物的结合导致ATP结合盒构象变化,使 之与ATP的亲和力增加。 3.ATP与ATP结合盒结合,使蛋白质构象发生变化,使两个ATP结合盒之间相互作用 力加强。 4.这种加强又影响了蛋白质两个跨膜域之间的相互作用,导致底物释放到细胞外。 5.ATP水解,释放ADP和无机磷酸,又将蛋白质结构恢复到起始状态。 真核生物ABC运输系统将胞内物质运输到细胞外,而原核生物的ABC运输系统常常将 胞外物质运输到细胞内。细菌有一个特殊的结合蛋白与ABC运输子联合作用,将底物供给 ABC运输子并刺激细胞内ATP水解。这些结合蛋白存在于细菌细胞的膜间隙(periplasm,就 是细菌的两层细胞膜之间的区室)。 因此,ABC运输系统的运输机制与P-类ATPase不同之处在于水解ATP与蛋白质构象变 化偶联。然而,这两种作用机制的净结果是相同的:即从膜一面结合底物的构型转化成另一 面释放底物的构型。 l3.3乳糖透过酶(lactose permease)是次级运输子的原型,利用另一物质的浓 度梯度来驱动这些次级运输子。 很多运输过程不是直接利用ATP水解产生的能量驱动的。这些运输子逆浓度梯度运送某 一离子或分子与另一离子或分子沿浓度梯度流动相偶联。这种运输子叫次级运输子或耦合运 输子(cotransporter)。将这些运输蛋白归类为反向运输者(antiporter)或共运送体(symporter)。 反向运输体将一种物质跨膜的逆浓度梯度运输与另一种物质跨膜的顺浓度梯度运输偶联,而 且两种物质跨膜运输的方向相反。共运送体将一种物质跨膜的逆浓度梯度运输与另一种物质 跨膜的顺浓度梯度运输偶联,但两种物质跨膜运输的方向相同。还有一类与此相关的蛋白叫 单一传递体(uniporter).,与离子通道一样,能够将特定物质沿着膜两面的浓度差进行双向 运输(图13.10)。 A B B 4 Antiporter Symporter Uniporter eei30ahEn 2007 W.H.Freeman and Company 图13.10反向运输体、共运送体、和单一传递体。次级运输子能够将两种物质跨膜反向运 输(反向运输体,antiporter)、同向运输(共运送体,symporter),或将单一物质跨膜双输 送(单一传递体,uniporter)
1. 运输子的起始状态既没有结合底物,也没有结合 ATP。运输子结合位点可以开放也 可以关闭。 2. 胞内底物进入开放形式运输子中央洞穴。底物的结合导致 ATP 结合盒构象变化,使 之与 ATP 的亲和力增加。 3. ATP 与 ATP 结合盒结合,使蛋白质构象发生变化,使两个 ATP 结合盒之间相互作用 力加强。 4. 这种加强又影响了蛋白质两个跨膜域之间的相互作用,导致底物释放到细胞外。 5. ATP 水解,释放 ADP 和无机磷酸,又将蛋白质结构恢复到起始状态。 真核生物 ABC 运输系统将胞内物质运输到细胞外,而原核生物的 ABC 运输系统常常将 胞外物质运输到细胞内。细菌有一个特殊的结合蛋白与 ABC 运输子联合作用,将底物供给 ABC 运输子并刺激细胞内 ATP 水解。这些结合蛋白存在于细菌细胞的膜间隙(periplasm, 就 是细菌的两层细胞膜之间的区室)。 因此,ABC 运输系统的运输机制与 P-类 ATPase 不同之处在于水解 ATP 与蛋白质构象变 化偶联。然而,这两种作用机制的净结果是相同的:即从膜一面结合底物的构型转化成另一 面释放底物的构型。 13.3 乳糖透过酶(lactose permease)是次级运输子的原型,利用另一物质的浓 度梯度来驱动这些次级运输子。 很多运输过程不是直接利用 ATP 水解产生的能量驱动的。这些运输子逆浓度梯度运送某 一离子或分子与另一离子或分子沿浓度梯度流动相偶联。这种运输子叫次级运输子或耦合运 输子(cotransporter)。将这些运输蛋白归类为反向运输者(antiporter)或共运送体(symporter)。 反向运输体将一种物质跨膜的逆浓度梯度运输与另一种物质跨膜的顺浓度梯度运输偶联,而 且两种物质跨膜运输的方向相反。共运送体将一种物质跨膜的逆浓度梯度运输与另一种物质 跨膜的顺浓度梯度运输偶联,但两种物质跨膜运输的方向相同。还有一类与此相关的蛋白叫 单一传递体(uniporter),与离子通道一样,能够将特定物质沿着膜两面的浓度差进行双向 运输(图 13.10)。 图 13.10 反向运输体、共运送体、和单一传递体。次级运输子能够将两种物质跨膜反向运 输(反向运输体,antiporter)、同向运输(共运送体, symporter),或将单一物质跨膜双输 送(单一传递体,uniporter)