
2.自由能的变化是化学反应的动力 自由能(free energy) 自由能是能够用于做功的能量。 反应物的自由能(G)与其焓、温度( 和熵(S)相关,等于其焓减去绝对温度和嫡的 乘积,即G=H-TS。 在生物系统中,生物分子在等温、等压条 件下,在化学反应中能量的变化可以用自由能 变(△G)来量度。 △G=△H-T△S 目录
目 录 2.自由能的变化是化学反应的动力 自由能(free energy) 自由能是能够用于做功的能量。 反应物的自由能(G)与其焓、温度(T) 和熵(S)相关,等于其焓减去绝对温度和熵的 乘积,即G = H TS 。 在生物系统中,生物分子在等温、等压条 件下,在化学反应中能量的变化可以用自由能 变( G)来量度。 G = H TS

自由能的变化是化学反应的动力,影响化学反 应的方向。 △G<0 反应为释能反应(exergonic reaction)可以自发进行 △G>0 反应为吸能反应(endergonic reaction)不能自发进行 △G=0 反应正逆向速率相等,反应处于平衡状态 目录
目 录 自由能的变化是化学反应的动力,影响化学反 应的方向。 G < 0 反应为释能反应(exergonic reaction)可以自发进行 G > 0 反应为吸能反应(endergonic reaction)不能自发进行 G = 0 反应正逆向速率相等,反应处于平衡状态
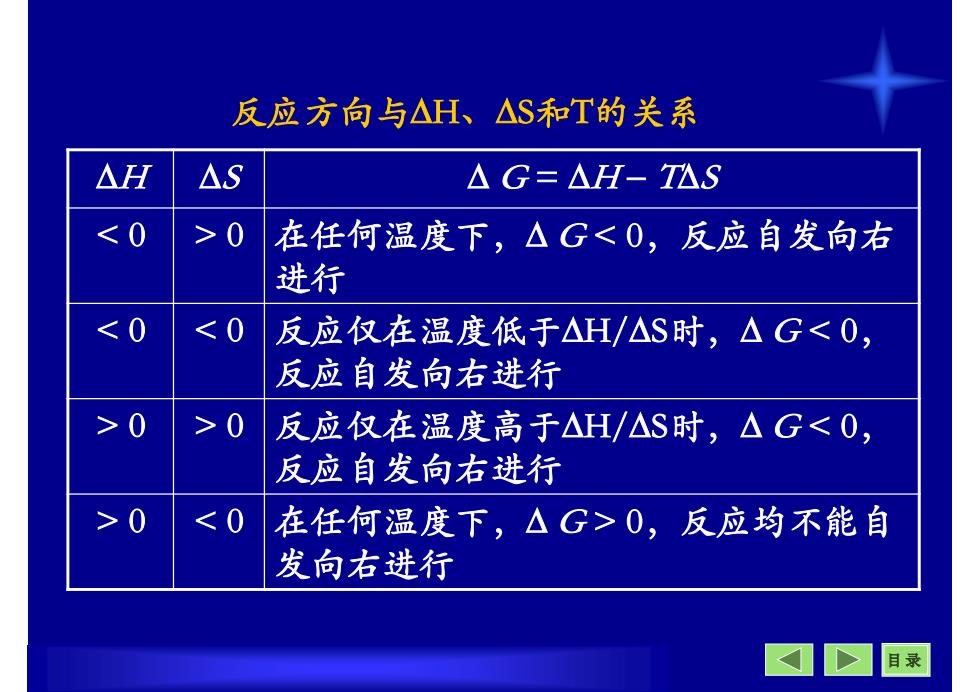
反应方向与△H、△S和T的关系 △H △S △G=△H-T公S <0 >0 在任何温度下,△G<0,反应自发向右 进行 <0 <0 反应仅在温度低于△H/△S时,△G<0, 反应自发向右进行 >0 >0 反应仅在温度高于△H/△S时,△G<0, 反应自发向右进行 >0 <0 在任何温度下,△G>0,反应均不能自 发向右进行 目录
目 录 反应方向与H、S和T的关系 H S G = H TS 在任何温度下, G < 0,反应自发向右 进行 < 0 > 0 反应仅在温度低于H/S时, G < 0, 反应自发向右进行 < 0 < 0 反应仅在温度高于H/S时, G < 0, 反应自发向右进行 > 0 > 0 在任何温度下, G > 0,反应均不能自 发向右进行 > 0 < 0

3.标准自由能变与平衡常数有关 标准自由能变(△G)是指在标准状态下的自由能变 标准状态: 压力=1大气压(101.3kPa) 温度=298K(25°C) pH=7.0 [S]=[P]=1mol/I 在S+S2 P+P2中 P[P2] △G=△G0'+RTln [S JIS2I 反应达到平衡时即△G=0 △G0'=-RTIn K'eg 目录
目 录 3.标准自由能变与平衡常数有关 标准自由能变(G0 ´)是指在标准状态下的自由能变 标准状态: 压力 = 1大气压(101.3kPa) 温度 = 298K(25C) pH = 7.0 [S]=[P]=1mol/l G = G0´+ RT ln [P1 ][P2 ] [S1 ][S2 ] 反应达到平衡时即 G = 0 G0´ = RT ln K’eq 在S1+S2 P1+P2 中

(二)动力学性质是对反应速率的描述 动力学是研究化学反应速率及其影 响因素的科学。 反应速率是单位体积内反应进度随时 间的变化率,任何反应速率均由底物浓度和 速率常数(rate constant,k)所决定。 目录
目 录 (二)动力学性质是对反应速率的描述 动力学是研究化学反应速率及其影 响因素的科学。 反应速率是单位体积内反应进度随时 间的变化率,任何反应速率均由底物浓度和 速率常数(rate constant, k)所决定