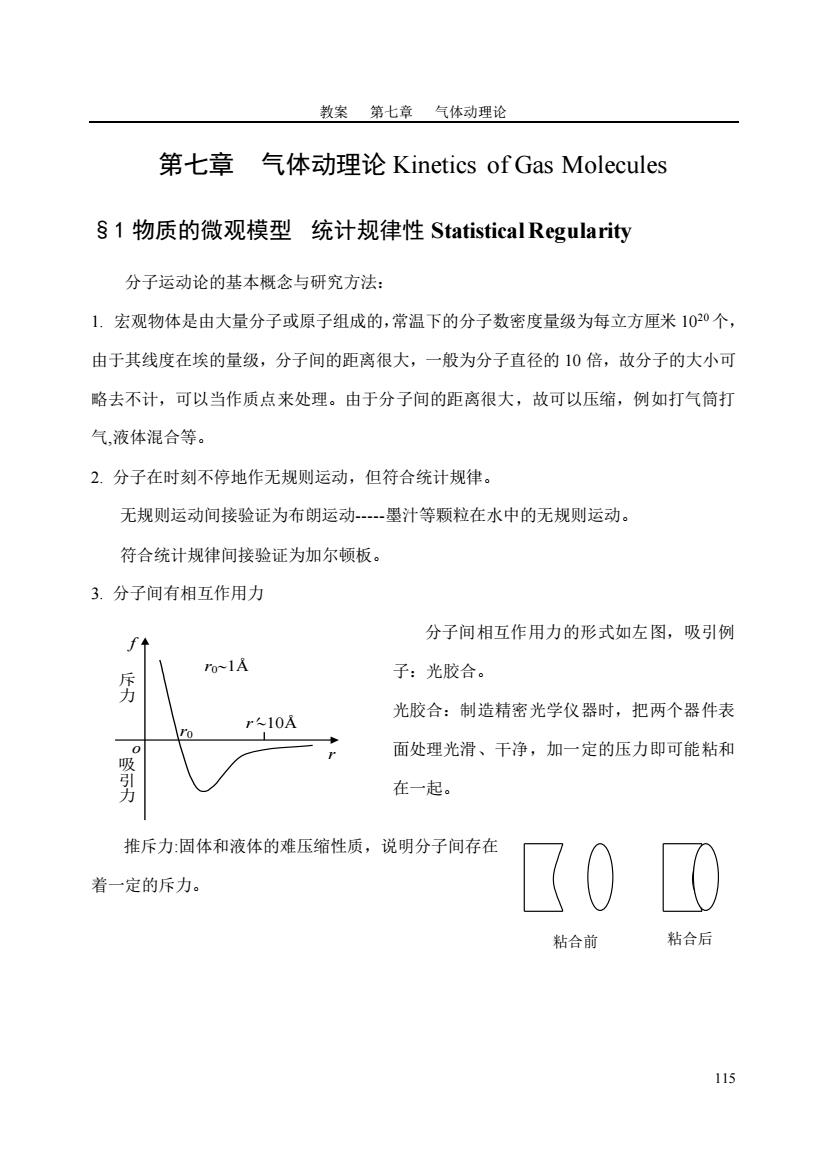
教案第七章气体动理论 第七章气体动理论Kinetics of Gas Molecules §1物质的微观模型统计规律性Statistical Regularity 分子运动论的基本概念与研究方法: 1.宏观物体是由大量分子或原子组成的,常温下的分子数密度量级为每立方厘米102个, 由于其线度在埃的量级,分子间的距离很大,一般为分子直径的10倍,故分子的大小可 略去不计,可以当作质点来处理。由于分子间的距离很大,故可以压缩,例如打气筒打 气,液体混合等。 2.分子在时刻不停地作无规则运动,但符合统计规律。 无规则运动间接验证为布朗运动一墨汁等颗粒在水中的无规则运动。 符合统计规律间接验证为加尔顿板。 3.分子间有相互作用力 分子间相互作用力的形式如左图,吸引例 ro-1A 子:光胶合。 光胶合:制造精密光学仪器时,把两个器件表 r-10A 面处理光滑、干净,加一定的压力即可能粘和 吸引力 在一起。 推斥力:固体和液体的难压缩性质,说明分子间存在 着一定的斥力。 粘合前 粘合后 115
教案 第七章 气体动理论 115 第七章 气体动理论 Kinetics of Gas Molecules §1 物质的微观模型 统计规律性 Statistical Regularity 分子运动论的基本概念与研究方法: 1. 宏观物体是由大量分子或原子组成的,常温下的分子数密度量级为每立方厘米 1020 个, 由于其线度在埃的量级,分子间的距离很大,一般为分子直径的 10 倍,故分子的大小可 略去不计,可以当作质点来处理。由于分子间的距离很大,故可以压缩,例如打气筒打 气,液体混合等。 2. 分子在时刻不停地作无规则运动,但符合统计规律。 无规则运动间接验证为布朗运动-----墨汁等颗粒在水中的无规则运动。 符合统计规律间接验证为加尔顿板。 3. 分子间有相互作用力 分子间相互作用力的形式如左图,吸引例 子:光胶合。 光胶合:制造精密光学仪器时,把两个器件表 面处理光滑、干净,加一定的压力即可能粘和 在一起。 推斥力:固体和液体的难压缩性质,说明分子间存在 着一定的斥力。 r f 斥 力 吸 引 力 o r0 r01Å r10Å 粘合前 粘合后

教案第七章气体动理论 s2理想气体的压力公式The pressure formula ofideal gas 1.理想气体模型 1)分子可看作质点。客体:分子本占的大小与分子间距离比较可忽略 2)分子间相互作用力可忽略不计。客体:分子间平均距离很大(标准状态下约为分子有 效直径的10倍,即10左右),此时分子间作用力很小,只有碰撞时才有冲力作用。 根据理想气体模型,可有如下几条假设(推论也可): (1)同类气体分子的质量相等与速率无关。 (2)碰撞为完全弹性碰撞。 (3)热平衡时,分子沿各个方向的运动几率相等。 (4)容器不是很大时,忽略重力的影响。 2.理想气体压力公式的推导 说明:本节是以压力公式的推导为例,探讨气体分子运动论的研究问题的方法。因此, 重点讲解其方法的运用。(提炼模型的素质,简化问题的素质)。 气体压力是由于分子与器壁碰撞而产生的冲力。以A面为例进行研究:建立如图所 示的坐标系,设容器中共有N个相同的气体分子。一个分子与器壁发生一次完全弹性碰 撞的动量改变为: mU.(mUa)=2mvn:(只考虑大小,没计方向) 在单位时间内,分子与器壁的碰撞次数为: 2x :2红是分子在A,与A,间运动所需时间,则单位 时间内,器壁受到的力为: 6
教案 第七章 气体动理论 116 §2 理想气体的压力公式 The pressure formula of ideal gas 1. 理想气体模型 1)分子可看作质点。客体:分子本占的大小与分子间距离比较可忽略。 2)分子间相互作用力可忽略不计。客体:分子间平均距离很大(标准状态下约为分子有 效直径的 10 倍,即 10 左右),此时分子间作用力很小,只有碰撞时才有冲力作用。 根据理想气体模型,可有如下几条假设(推论也可): (1)同类气体分子的质量相等与速率无关。 (2)碰撞为完全弹性碰撞。 (3)热平衡时,分子沿各个方向的运动几率相等。 (4)容器不是很大时,忽略重力的影响。 2. 理想气体压力公式的推导 说明:本节是以压力公式的推导为例,探讨气体分子运动论的研究问题的方法。因此, 重点讲解其方法的运用。(提炼模型的素质,简化问题的素质)。 气体压力是由于分子与器壁碰撞而产生的冲力。以 A 1 面为例进行研究:建立如图所 示的坐标系,设容器中共有 N 个相同的气体分子。一个分子与器壁发生一次完全弹性碰 撞的动量改变为: m ix -(-m ix )=2 m ix ;(只考虑大小,没计方向) 在单位时间内,分子与器壁的碰撞次数为: x x 2 ; x x 2 是分子在 A 1 与 A 2 间运动所需时间,则单位 时间内,器壁受到的力为: x y z z y A1 A2 o x -mvx mvx v

教案第七章气体动理论 2mu2m2+中2mue会 2x -u+u++ue p=E.m(w2+叶ua2++u =Nwu.2++2++ueW 2 =n'm.v2 0F=0+0+0☑ 而v2=v2=v2(几率相等) G=m0为分子的平均平动动能 3.压力公式的物理意义 1)P正比于n和.是一个统计量,只对大量气体分子适用 2)把宏观量和微观量联系在一起了。 说明:因为微观量不能测量,故不能直接用实验来检验其正确性,但从此公式出发,可 以满意的解释或论证已经过实验检验的气体诸定律。 例题1:球形器壁内压强公式的推导。 解:如图,设碰撞为完全弹性碰撞矮子每次碰撞中,分 子作用于器壁的法向冲量为:2mU,Cos0:单位时间内 2 U 的隧撞次数为:2心0:则每秒作用于器壁的冲量 N个分子 117
教案 第七章 气体动理论 117 F=2 m 1x x x 2 1 + • • •+2 m ix x ix 2 + • • •+2 m Nx x Nx 2 = x m ( 2 1x + • • •+ 2 ix + • • •+ 2 Nx ) P= yz F = xyz m ( 2 1x + • • •+ 2 ix + • • •+ 2 Nx ) = xyz N •M•( 2 1x + • • •+ 2 ix + • • •+ 2 Nx )/N =n •m • 2 x 2 = 2 x + 2 y + 2 z = 3 1 n m 2 而 2 x = 2 y = 2 z (几率相等) = 3 2 n ( 2 1 m 2 ) = 3 2 n = 2 1 m 2 :为分子的平均平动动能. 3. 压力公式的物理意义 1)P 正比于 n 和 .是一个统计量,只对大量气体分子适用。 2)把宏观量和微观量联系在一起了。 说明:因为微观量不能测量,故不能直接用实验来检验其正确性,但从此公式出发,可 以满意的解释或论证已经过实验检验的气体诸定律。 例题 1:球形器壁内压强公式的推导。 解:如图,设碰撞为完全弹性碰撞矮子每次碰撞中,分 子作用于器壁的法向冲量为:2m i Cos ;单位时间内 的碰撞次数为: RCos i 2 ;则每秒作用于器壁的冲量 vi vi R O 2Rcos N 个分子

教案第七章气体动理论 U,_m心 为(一个气体分子):加u0s02RCg发:番壁每秒受到的总冲量为: 压强号贤4- R 34 m 即:球形器壁内压强公式与立方形的完全相同,对其他形状的器壁与完全是同样的结论, 因为此较复杂,这里就不一一证明了。 问:如是任意形状容器,从理论上讲怎样证明?(采用卡诺定理的证明方法,用无限多 个方形和球形容器代替。) §3气体分子的平均平动动能与温度的关系The temperature formula ofideal gas 在PV=MT中:设分子质量为,分子数为N,则有: N N。m 光是mT (1) 中为分子度:是180为尔发侧 常数:N为阿伏伽德罗常数(Avogadto)): 而 (2) 118
教案 第七章 气体动理论 118 为(一个气体分子):2m i Cos RCos i 2 = R m i 2 ;器壁每秒受到的总冲量为 : = N i 1 R m i 2 = R m = N i i 1 2 ; 压强 P= S F =( R m = N i i 1 2 )/4 2 R = 3 1 3 3 4 R N m N N i i =1 2 = 3 1 n m 2 即:球形器壁内压强公式与立方形的完全相同,对其他形状的器壁与完全是同样的结论, 因为比较复杂,这里就不一一证明了。 问:如是任意形状容器,从理论上讲怎样证明?(采用卡诺定理的证明方法,用无限多 个方形和球形容器代替。) §3 气体分子的平均平动动能与温度的关系 The temperature formula of ideal gas 在 PV= M RT 中:设分子质量为 m,分子数为 N,则有: PV= N m Nm 0 RT= N0 N RT P= N0 N V RT = V N N0 R T=n k T (1) 其中 n= V N 为分子数密度;k= N0 R = 23 6.02 10 8.31 =1.38 10 −23 J•k −1 为玻尔兹曼(Boltzmann) 常数;N0 为阿伏伽德罗常数(Avogadto); 而 P= 3 2 n (2)

教案第七章气体动理论 由(1),(2)得: 9 说明T=0是不可能的(量子理论观点既运动是绝对的)。 此处加入方均根速率:V厅:3产。,7 μVm (③)式说明:温度是表征大量气体分子热运动激烈程度的物理量,平均平动动能与温度成 正比。同压力一样,温度也是一个统计量。 量级的概念:当T=300k时,8=102'J相当之小。 §4能量均分定理.理想气体内能Equilibration Theorem of Energy,The internal energy ofideal gas 1.自由度 决定一物体的空间位置所需要的独立坐标数目。一个在空间自由运动的质点,自由 度为3.(xy,z,=3一个刚性双原子分子自由度为5(x,y,Z,a,0,=5:因为三个角度中 只有两个是独立的。 2.能量按自由度均分定理 单原子理想气体的平均平动动能为:石=k虹,单原子气体分子有三个自由度,而气 体分子在各个方向上的运动几率相等,故有: 21 即:在平衡状态时,理想气体分子的每个自由度都具有大小等于)kT的能量,这个定理 叫做能量按自由度均分定理。 119
教案 第七章 气体动理论 119 由(1),(2)得: = 2 3 kT (3) 说明 T=0 是不可能的(量子理论观点既运动是绝对的)。 此处加入方均根速率: 2 = 3RT = m 3kT (3)式说明:温度是表征大量气体分子热运动激烈程度的物理量,平均平动动能与温度成 正比。同压力一样,温度也是一个统计量。 量级的概念:当 T=300k 时, =10 −21 J 相当之小。 §4 能量均分定理.理想气体内能 Equilibration Theorem of Energy,The internal energy of ideal gas 1. 自由度 决定一物体的空间位置所需要的独立坐标数目。一个在空间自由运动的质点,自由 度为 3.(x,y,z),i=3 一个刚性双原子分子自由度为 5(x,y,z,,),i=5:因为三个角度中 只有两个是独立的。 2. 能量按自由度均分定理 单原子理想气体的平均平动动能为: = 2 3 kT,单原子气体分子有三个自由度,而气 体分子在各个方向上的运动几率相等,故有: 2 1 m 2 x = 2 1 m 2 y = 2 1 m 2 z = 2 1 k T 即:在平衡状态时,理想气体分子的每个自由度都具有大小等于 2 1 k T 的能量,这个定理 叫做能量按自由度均分定理