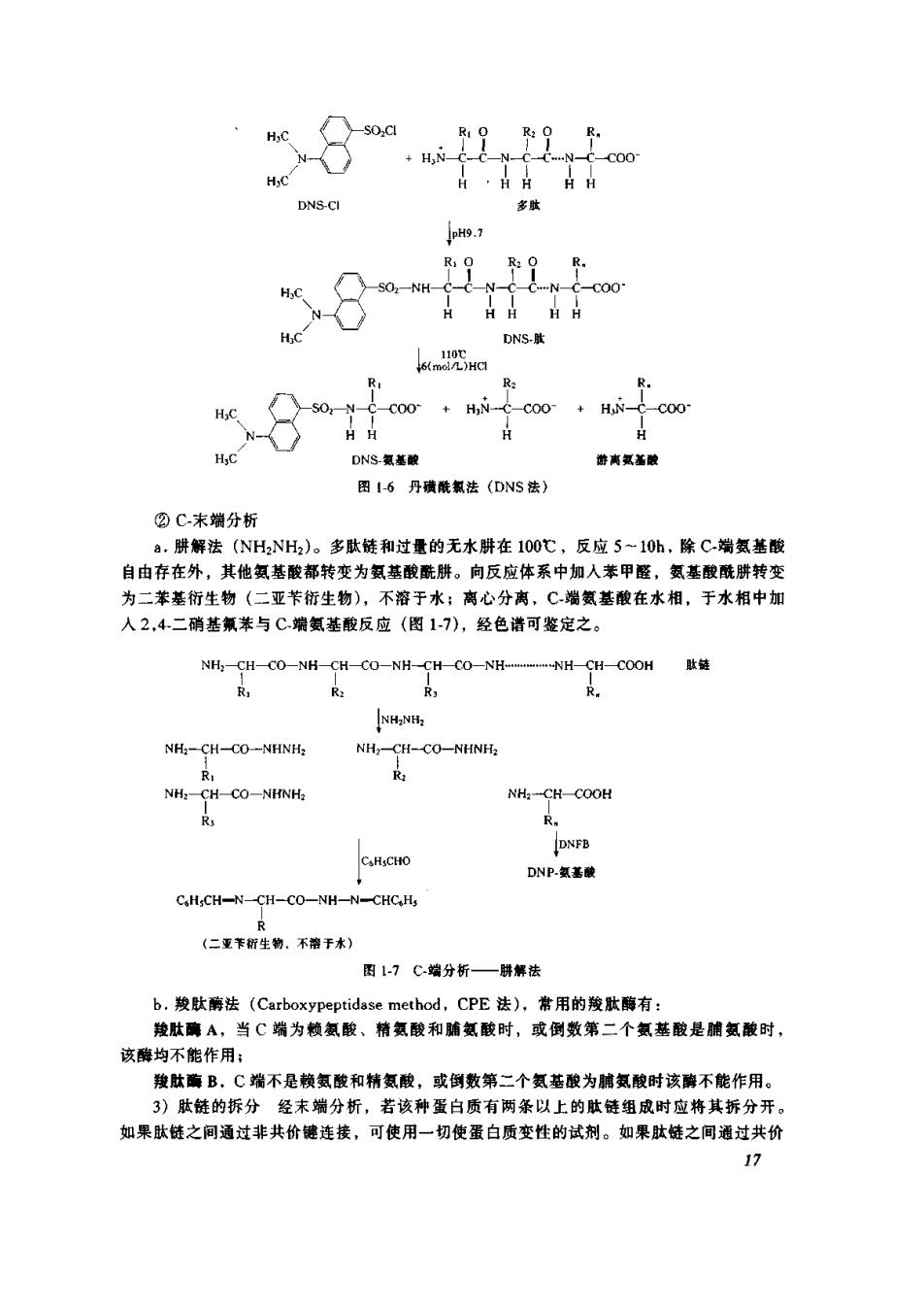
N c00 H·HHH pH9.1 C-N- C00 HA日h H.C kn咒Ha -COO-HN-C-COO H.C DNS氮基酸 图16丹预酰氯法(DNS法) ②C末端分析 a.肤解法(NH2NH2)。多肽徒和过量的无水肼在100℃,反应5~10h,除C-端氨基酸 自由存在外,其他氨基酸都转变为氨基酸酰。向反应体系中加人苯甲醛,氢基酸酰肼转变 为二苯基衍生物(二亚苄衍生物),不溶于水:离心分离,C端氨基酸在水相,于水相中加 人2,4.二硝基瓶苯与C端氨基酸反应(图17).经色谱可鉴定之。 NH一CH-CO-NHCH-CO-NH-CH一CO一NHWH-CH一COOH链 R NHNE NH;-CH-CO-NHNH: NH,-CH-CO-NHNH; R R: NH:-CH-CO-NHNH, NH:-CH-COOH R R. DNFB C.H.CHO DNP.基破 C.H;CH-N-CH-CO-NH-N-CHCHs (二亚节斩生物。不溶于水) 图1-7C端分析一群解法 b.羧法(Carboxypeptidase method,CPE法),常用的羧肽酶有 羧肚璃A,当C端为籁氨酸、精氨酸和脯氨酸时,或倒数第二个氨基酸是脯氨酸时, 该酶均不能作用; 羧肽B,C端不是赖氨酸和精氨酸,或倒数第二个氨基酸为鹏氨酸时该酶不能作用。 3)肽链的拆分经末端分析,若该种蛋白质有两条以上的肽链组成时应将其拆分开 如果肽链之间通过非共价德连接,可使用一切使蛋白质变性的试剂。如果肽链之间通过共价

键相连(主要是二硫键),可采用过甲酸氧化或基乙醇还原的方法。 链 HCOOOH HSCH.CH.OH SH ICH:-COOH S-CH.COOH 洲 CH.COOH 如Sanger利用2,4.二硝基额莱法分析胰岛素的结构,得到了一个DNP.甘氢酸和一个 DNP羊丙氨酸,确知胰岛素有两条肽链组成。用过甲酸氧化,电泳或色谱法分离得到两个 肽段: 一个含酸性基酸多,N末端为甘氨酸,称它为A链;另一个肽含碱性氢基酸多 N末端为苯丙氨酸,称它为B链。 4)肽链中氨基酸排列顺序的确定一般使用片段重叠法。一些专一性的蛋白水解鬓或 化学试剂,能使蛋白质的多肽链在特定的部位断裂,产生一些大小不同的重叠片段,分离纯 化这些肽段,测定每一个肽段的氯基酸顺序,根据这些重叠的片段,推断出完整肽链的氨基 酸排列顺序。常用的断裂多肽链的方法有以下几个。 ①漠化氰(CNBx)裂解法它专一性水解甲硫氨酸的羧基形成的肽。澳化水解的 结果产生以高丝氨酸内酯结尾的肽,高丝氨酸内雷是甲硫氨酸转变来的。 H O H O N-C-C-N -N-C- C-0+HN HR日HHR, R CH: 耿酰高丝氯酸内南 ②胰蛋白藤水解法胰蛋白酶专一性水解赖氨酸和精氢酸的陵基形成的肽健。但是, 如果赖氨酸和精氨酸的羧基与魄氨酸相连,则该酶不能作用。 ③胰凝乳蛋白酶(糜蛋白酶)水解法它专一性水解疏水性氨基酸,主要是略氨酸 苯丙氨酸和色氮酸的羧基形成的肽健。若与它们的羧基相连的氨基酸为鹏氨酸,该靡不能 水解。 ④胃蛋白酶水解法它要求断裂健的两侧的氨基酸都是水性的氨基酸 ⑤金黄色葡萄球蓝蛋白醉(谷氨酸蛋白酶)水解法它专一性水解谷氢酸和天门冬氨 酸的羧基形成的肽健。 校状芽孢杆菌蛋白酶(精氨酸蛋白酶)水解法它能水解精氨酸的羧基形成的肚健 5)分离纯化部分降解的肽片段 分折每一片段的氨基酸组成和排列顺序。 6)确定二班健的位量。 T)根据重叠肽的氨基酸顺序,推出完整肽的氨基酸顺序由于蛋白质的一级结构归根 18

到底是基因表达的结果,因此测定脱氧核糖核酸DNA核苷酸序列,就能间接分析出蛋白度 多肽链中氨基酸的排列顺序。随着DNA序列测定技术的发展,许多蛋白质一级结构的测定 工作已经完成 二、蛋白质的二级结构 1.二级结构的概念 多肽链的基本结构如图13所示。多肽链主链形式上都是单健,可以设想一个多肽主链 将可能有无限多种构象,但实际不然。在生物体内 个蛋白质只有 种或很少几种 构象。 蛋白质二级结构(secondary structure)的形成,主要是其多肽链的主链骨架上所含的 濮基和亚氨基,在主徒骨架盘绕折叠时可以形成氢键,依靠这种氢键的维持固定,多肽徒主 链骨架上的若干肽段可以形成有规律性的空间排布,而其他部分在空间的排布则是无规则 的,如无规则的卷曲结构。这种由多肚链主链骨架盘绕折叠,依靠氢健维持固定所形成的有 规律性的结构称为蛋白质的二级结构,包括无规则卷曲结构。二级结构与侧链R的构象无 关。维持二级结构稳定的化学键主要是氯键。 早在20世纪30年代后期,Linus Pauling and Robert Corey就开始用X射线衍射法分析 氨基酸和肽的精确结构,希望获得这些构件的标准健距和键角,并用这些资料去预测蛋白质 的构象,他们的重要发现之一是确定了肽单位。肽单位是多肽链中从一个a酸原子到相邻 碳原子之间的结构(图18)。 0 H Ca 放平面 图18多肽链主链骨架的构象 根据立体化学结构原则,肽单位的构象具有三个显著的特征。 (1)肽单位是一个刚性的平面结构这是由于肽键中的C一N键(0.132nm)比一般的 C-N单键(0.147nm)要短些,而比一般的C-N双键(0.128nm)要长些,因而具有部分 双健的性质(40%),不能自由旋转。使得肽单位所包含的六个原子处于同一个平面上,这 个平面又称为酰胺平面或肽平面(图1.9)。 (2)肽平面中炭基的氧与亚氨基的氢可以有顺式和反式两种排布X射线分析方法得到 的天然蛋白质晶体结构中,已证明多肽链中绝大多数肽单位上炭基的氧和亚氨基的氢都以反 式存在。因为反式是热力学上较稳定的形式。仅XP0之间的肽健可以是顺式的,X代表任 意一个氨基酸(图1-10)。因为哺氨酸的吡咯烷环的8碳原子在反式时易与邻近的氨基酸测 链发生空间排斥。顺式脯氧酸肽键右利于肽特在此处转折

b CgN和CgC CC-N1 (e) 图1.9状平面中的标准键长(A)(1A=0.1nm) (3)C,和亚氨基N及联基C之间的键是-个单键(0.146nm及0.l5nm),均可以自由 旋转C。一N键旋转的角度通常用本表示;C。 C健旋转 的角度用中表示,它们被称为C。原子的二面角(图111)。 角以C。 C键对N 一H键呈反式时为0°,角以C。 -N 键对C一0健呈反式时为0'。相邻的两个酰胺平面通过C。相 对旋转的程度决定了两个相邻的肽平面的相对位置。于是肽平 面就成为肽链盘绕折叠的基本单位,也是蛋白质之所以会形成 各种立体构象的根本原因。肽单位的二面角都可以在0 180℃范围内变动,使肽链出现多种不同二面角的主链构象 如 一条歌链从N端到C端,每一个连接处的二面角都各自 取相同的值,但不等于180时,如中=57,= -48,产生的 结构将是有规律性的结构。 注意:在研究一级结构时,氨基酸残基被看成是一个最小 ●个 的单位,在研究蛋白质的高级结构时,肽链中的最小单位是肽 单位。多肽链中所有的肽单位都具有相同的键长和健角。所以 图110顺式XP肽健 多肽链的骨架结构可以写成锯齿状。 由于肽平面的存在,大大限制了主链所能形成的构象数目,但如果没有这个平面的有 在,蛋白质多肽链的主链的自由度过大,而导致蛋白质不能形成特定的构象。 2 二级结构的主要类型 条多肽链可以折叠成什么样的规则结构?为了解决这一问题,Pauling和Corey建立 了多种分子模型,仔细地观察了氨基酸和小肽的健角和键距,于1951年提出了两个结构模 型,分别称为。螺旋结构和日折叠结构。 (1)a-螺旋(a-helix)结构 1)α·螺旋结构是一个类似棒状的结构从外观看,紧密卷曲的多肽链构成了棒的中心 部分,侧R伸出到螺旋排布的外面(图1-12)。完成一个螺旋,需3.6个氨基酸残基。螺 旋每上升一圈,相当于向上平移0.54nm,即螺旋的螺距为0.54nm。相邻两个氨基酸残基之 间的轴心距为0.15nm。 20

因11周个欧平面的相对位置 2)α-螺旋结构的稳定主要靠链内的氢键氢键形成于第一个氨基酸的羧基与线性顺序 中第五个氨基酸的氨基之间(图1-13)。氢键环内包含 13个原子,因此称这种螺为3.6(13)螺旋 3)大多数蛋白质中存在的。-螺旋均为右手螺旋。 4)一条肽链螺旋结构的形成以及是否稳定,与它 的氨基酸组成有关一般来说、甘氨酸、胸氨酸不易 形成。螺旋结构。两个或两个以上相邻的残基上带有 相同的电荷时,如多聚粮氢酸(poly Lys)和多聚谷氨 酸(poly Glu)不易形成a螺旋结构。两个或两个以上 R 相邻的氨基酸残基上带有较大的侧徒时,如ee Ile,Val-Val-Val,Leu-Leu.Leu等,都会阻止a螺 旋结构的形成。连续的几个丝氨酸或苏氨酸,由于羟 基与氢健有强烈相吸的倾向,而破坏α-螺旋的形成。 不同蛋白质中a螺旋含量不同。有些蛋白质中, 如肌红蛋白、血红蛋白,主要是由螺旋结构组成的。 有的蛋白质中,如y球蛋白、肌动蛋白中几乎不含。 螺旋结构;有的蛋白质,如毛发中的a角蛋白(ker atin),是以a螺旋作为基本结构的。 a螺旋的国际表示法,以n,表示。n指每个螺旋 中所包含的氨基酸残基数;s指氢键环内共价键所连接 的原子数。 (2)B-折叠结构B-折叠结构(P-pleated sheet) 又称为B折叠片层结构、已结构等。它是肽链主链或 某一肚段的一种相当伸展的结构(图114),多肽链星 扇面状折叠。 图112-螺旋结构