
病人潔 章 和

第二十章酸和碱 §20.1 Bronsted 酸 1923年Bronsted J Ni和Lowry T M各自独立提出了酸 和碱的定义:酸是质子给予体,碱是质子受体。 20.1.1酸的强度 酸的强度一般在水溶液中测定。酸(HA)在 水溶液中达成电离平衡: HA H20 H30+A 平衡常数为 [H3O][A] Kas [HA] 作为溶剂水的浓度基本不变,因此Ka是近似值
1923年BrØnsted J N和Lowry T M 各自独立提出了酸 和碱的定义:酸是质子给予体,碱是质子受体。 HA + H2O H3O + A + _ 第二十章 酸和碱 §20.1 BrØnsted 酸 20.1.1 酸的强度 酸的强度一般在水溶液中测定。酸(HA)在 水溶液中达成电离平衡: 平衡常数为 [H3 O + ][A - ] [HA] Ka≈ 作为溶剂水的浓度基本不变,因此Ka是近似值

第二十章 §20.1 Bronsted酸 20.1.1酸的强度 由于结构不同的酸的酸度可以相差几个数量级, 一般把Ka换算成pKa(=-lgKa);pKa的数值越小 酸性越强。 水是溶剂,又是酸也是碱。水的pa=15.74。 H20+H20=H30+0H pKa<16的酸不能在水中测定强度,却可以在碱性比水更 强的溶剂中测定。例如: 溶剂: 甲醇 pKa=14~20 DMSO pKa=13~18 环己胺 pKa=18~32
H2O + H2O H3O + OH + _ 第二十章 §20.1 BrØnsted 酸 20.1.1 酸的强度 由于结构不同的酸的酸度可以相差几个数量级, 一般把Ka换算成pKa(=-lgKa); pKa 的数值越小 酸性越强。 水是溶剂,又是酸也是碱。水的pKa=15.74。 pKa<16的酸不能在水中测定强度,却可以在碱性比水更 强的溶剂中测定。例如: 溶剂: 甲醇 pKa=14~20 DMSO pKa=13~18 环己胺 pKa=18~32
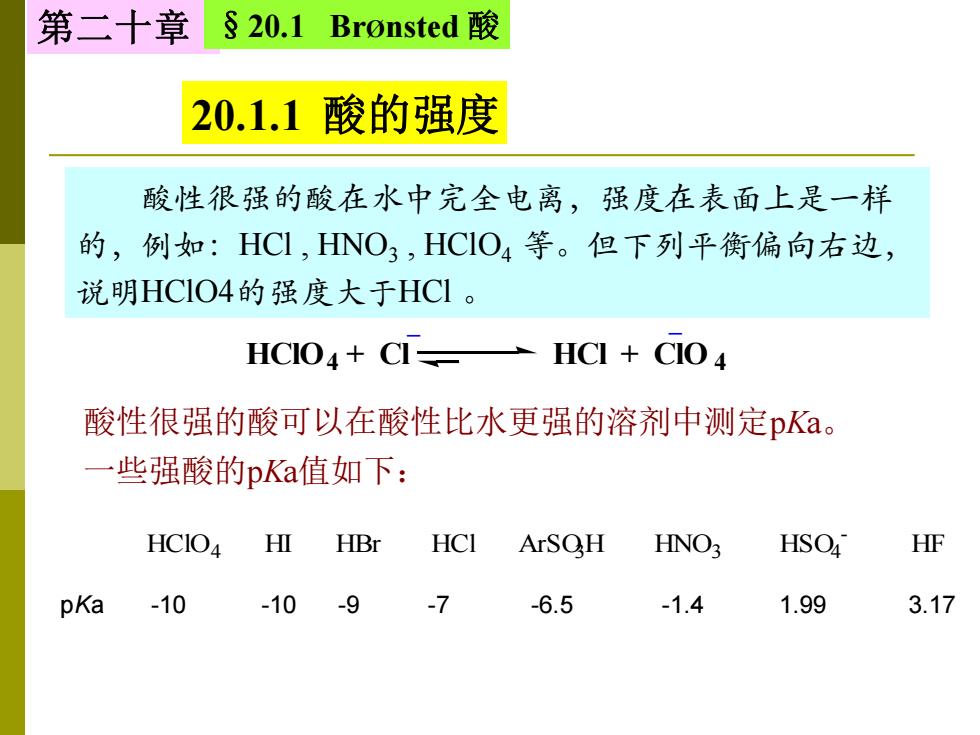
第二十章 S20.1 Bronsted酸 20.1.1酸的强度 酸性很强的酸在水中完全电离,强度在表面上是一样 的,例如:HCI,HNO3,HCIO4等。但下列平衡偏向右边, 说明HCIO4的强度大于HCl。 HCIO4+CI=— HCI CIO 酸性很强的酸可以在酸性比水更强的溶剂中测定pKa。 一些强酸的pKa值如下: HCIO HI HBr HCI ArSOH HNO HSO HF pKa -10 -10 -9 -7 -6.5 -1.4 1.99 3.17
HClO4 + Cl HCl + ClO 4 _ _ 第二十章 §20.1 BrØnsted 酸 20.1.1 酸的强度 酸性很强的酸在水中完全电离,强度在表面上是一样 的,例如:HCl , HNO3 , HClO4 等。但下列平衡偏向右边, 说明HClO4的强度大于HCl 。 酸性很强的酸可以在酸性比水更强的溶剂中测定pKa。 一些强酸的pKa值如下: pKa -10 -10 -9 -7 -6.5 -1.4 1.99 3.17 HClO4 HI HBr HCl ArSO3H HNO3 HSO4 - HF

第二十章 §20.1 Bronsted酸 20.1.2碱的强度 每一个酸(HA)在电离时都生成一个碱(A)成为它 的共轭碱;每一个碱接受质子后都变成它的共轭酸。碱的 强度一般用它的共轭酸的pKa来表示,pKa值越大,碱性越 强,pKa值越小,碱性越弱。例如: NH4" ArNH RC+-OH pKa 9.24 3~5 -7 温度对碱性强弱也有影响。例如: >50℃时 BuOH H2O>Bu2O 1~50℃时 BuOH Bu2O>H2O 对于中性分 <1℃时 子压力有利 Bu2O>BuOH H2O 于电离
第二十章 §20.1 BrØnsted 酸 20.1.2 碱的强度 每一个酸(HA)在电离时都生成一个碱(A-)成为它 的共轭碱;每一个碱接受质子后都变成它的共轭酸。碱的 强度一般用它的共轭酸的pKa来表示, pKa值越大,碱性越 强, pKa值越小,碱性越弱。例如: pKa 9.24 3~5 -7 NH4 + ArNH3 + R2 C + =OH 温度对碱性强弱也有影响。例如: >50℃时 BuOH > H2O > Bu2O 1~50 ℃时 BuOH > Bu2O > H2O <1℃时 Bu2O > BuOH > H2O 对于中性分 子压力有利 于电离