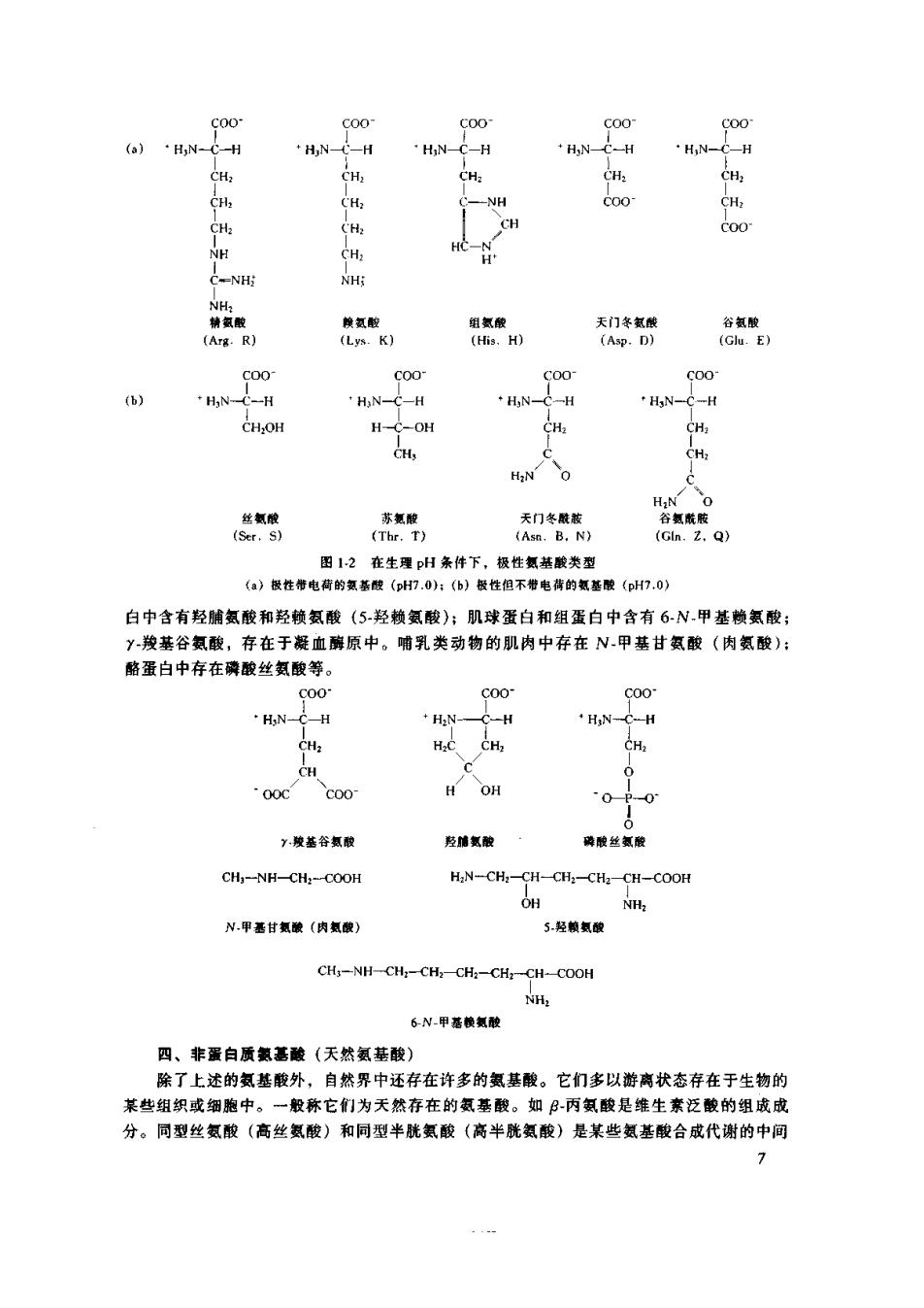
Coo- C00 C00 (. HN- ·H,N-CH 精氯酸 酸 天门冬氯酸 Arg.R Lys (As.D)】 c00 C00 6) HN-C-H C-H ·HN-C-H ·N -H CH.OH CH. CH 天们冬酰装 田12在生理H条件下,极性氮恭酸类型 (a)极性电荷的氮蕃酸(H.0:()极性但不看电传的基酸(pH7.0) 白中含有羟脯氨酸和羟赖氨酸(5羟赖氨酸);肌球蛋白和组蛋白中含有6N.甲基赖氨酸 Y羧基谷氨酸,存在于凝血酶原中。哺乳类动物的肌肉中存在N甲基甘氨酸(肉氨酸): 酪蛋白中存在磷酸丝氨酸等。 00 C00 c00 HNCH HN-C-H ·H;N-C-H HC CH, c ooc c00 "0 Y,骏基谷氢胶 羟墙氨酸 装酸丝氮酸 CH,-NH-CH:-COOH H:N-CH:-CH-CH:-CH2-CH-COOH OH N甲甘氨酸(肉氢酸 5经氨酿 CH,-NH-CH:-CH,-CH:-CH:-CH-COOH NH: 6N-甲蕃懒氢酸 四、非蛋白质氯基酸(天然氨基酸) 除了上述的氨基酸外,自然界中还存在许多的氨基酸。它们多以游离状态存在于生物的 某些组织或细胞中。一般称它们为天然存在的氨基酸。如B丙氨酸是维生素泛酸的组成成 分。同型丝氨酸(高丝氨酸)和同型半胱氨酸(高半胱氨酸)是某些氨基酸合成代谢的中间 7

产物。脑组织中存在有Y氨基丁酸,西瓜中含有瓜氨酸,瓜氨酸和鸟氨酸与尿素的合成密 切相关。牛磺酸广泛存在于动物细胞中,多以游离形式存在。1927年,首次从牛胆中分离 到,植物中尚未发现它的存在,它不参与任何蛋白质的合成,但可参与某些小肽的组成,如 脑组织中的y,谷氮酰牛磺酸。 H.NCHCH-CH-CHCOOH H,NCH-CH.CH-COOH H-NCONHCH CHCH,CHCOOH NH L鸟氨酸 Y.氨英丁酸 L瓜氨酸 H,NCH-CH,COOH HO,S CH:-CH,-NH, CH:-CH:-CH-COOH CH:-CH:-CH-COOH OH SH NH. 2丙氮酸 牛碳酸 高丝氨酸 高半洗氨酸 五、D氨基酸研究进展 D氮基酸在生物界普遍存在,尤其植物组织中。在微生物体内存在的D氨基酸,多以 结合态存在。如短杆菌肽S中存在D-苯丙氨酸,多粘菌肽中含D丝氨酸和D亮氨酸。动物 体内的D氨基酸多以自由态形式或小肽形式存在。如家蚕血液和近蚓体内含有D.丝氨酸, 人牙齿蛋白中含有D精氨酸 ,它的含量变化与人的年龄及衰老有关。D氨基酸的存在与某 些蛋白质的功能密切相关。如萤火虫尾部的发光物质一荧光素,含有D半胱氨酸。如果 换以L-半胱氨酸,不能发光。同样青需素分子中的D半胱氢酸若换以L型的,则失去抗菌 效能。 六、氨基酸的一般性质 氨基酸均为无色结品体或粉末状,每种氨基酸都有自己特有的结晶形状,可用于鉴定。 与相应的有机酸比较,基酸的熔点较商,一般都大于200℃。如甘氨酸的熔点为232℃, 而相应的乙酸的熔点为16.5℃。 在可见光区氨基酸均无吸收。在近紫外区(220一300m),苯丙氨酸、酪氨酸和色氨酸 都有吸收,由于三者结构上的差异,最大吸收不同。酪氨酸的最大吸收波长(入)为 275-278nm,苯丙氨酸为257~259nm,色氢酸为279-280nm。 组成蛋白质的氨基酸,除甘氨酸外,均含有不对称碳原子,故具有旋光性。在一定的温 度和溶剂系统中,不同的氨基酸都有各自的比族光值,可用于定性鉴定。有些氢基酸,如苏 氨酸、异亮氨酸等,含有两个不对称碳原子,因此有四个非对映异构体;其中两个分别称为 L·和D-型,另外两个称为L-别和D别,所以有别苏氨酸、别异亮氨酸等名称 除胱氨酸、半胱氨酸、酪氨酸外,氨基酸一般溶于水。但在稀酸、稀碱中溶解最好。除 脯氨酸溶于乙醇、乙醚外,绝大多数氯基酸都不溶于有机溶剂,故可用有机溶剂沉淀法生产 氯基酸。脯氨酸极易溶解于水中,故易潮解不易制成结品 世界上凡是可食的东西,都有自己特有的味道。氨基酸也不例外。许多山珍海味,给人 以美味的感觉享受,莫不与氨基酸的存在有关。大米的香味是由于胱氨酸的存在,啤酒的苦 味,其原因之 一是由于三个支氨基酸的存在 七、氯善酸的化学性质 氨基酸的化学性质是由它的结构决定的,不同氨基酸之间的差异仅在侧链上,因此氨基 酸具有许多共同的性质 个别氨基酸由于侧链的特殊结构尚有许多特殊的性质。 1,两性性质和等电点

根据Bronsted-lowry的酸碱理论,氨基酸分子中既含有羧基,又含有氨基,故它是两性 电解质(ampholyte)。 根据氨基酸的某些物理性质,如熔点高,易溶干极性溶剂等可以判定品体状态或水溶液 中的氨基酸,应以两性离子形式存在。两性离子(dipolarrion,dipolar ion),又称为兼性离 子(zwitterion),偶极离子,即在同一个分子中含有等量的正负两种电荷。 NH, H-C-COOH 中性分于形式 两性离子形式 雷曼(Raman)证明,有机酸的骏基在1730cm有吸收光带,有机胺的氨基在 3300cm'处有吸收光带,而氨基酸虽含有氨基和羧基,但在这两处均无吸收,说明品体或 水溶被中的氨基酸不是以中性分子形式存在。 氨基酸既是两性电解质,它在溶液中的带电情况,随溶液的pH的变化而变化。改变溶 液的H,可以使氨基酸带正电,或带负电。以甘氨酸为例,它完全质子化时,可以看作是 一个多元的酸,其解离情况如下: H H HaN-C H 43 在一定的pH条件下,氨基酸分子中所带的正电荷和负电荷数相同,即净电荷为零,此 时溶液的pH称为该种氨基酸的等电点(isoelectric point)。氨基酸的等电点是它呈现电中 性时所处环境的pH。也就是说,溶液中的氨基酸绝大多数以两性离子形式存在,少部分是 等量的正离子和负离子,因而净电荷为零。氨基酸既不向正极移动,也不向负极移动。不同 氨基酸由于分子中所含的可解离基团不同,解离程度不同,等电点不同。在等电点时,氨基 酸的物理性质有所不同,最显著的特性是溶解度降低。氨基酸的等电点可由实验测定,也可 据氨基酸分子中所带的可解离基团的K值来计算,如根据上述甘氨酸的解离方程,可 得到: K:=[H](Gly'-) 「GHw+1 (1-1) (1-2) 根据等电点的定义,当[Gy】=【Gy】时,溶液的pH即为氨基酸的等电点。那 么,从式(11)和式(1-2)可导出下式: [H'I[Gly']K:[Gly'] K H丁 (1.3) 式(1,3》整理得:K1K2=【H]户,两边取对数得pH=乞(pK1+pK,) 从上述结论知,等电溶液的pH与离子浓度无关,其值决定于两性离子两侧的可解离基 团的pK值。 2.由。~氨基和a~羧基共同参加的化学反应 (1)苗三酮反应(ninhydrin reaction)在pH5~7和80~100℃条件下,大多数氨基酸 9
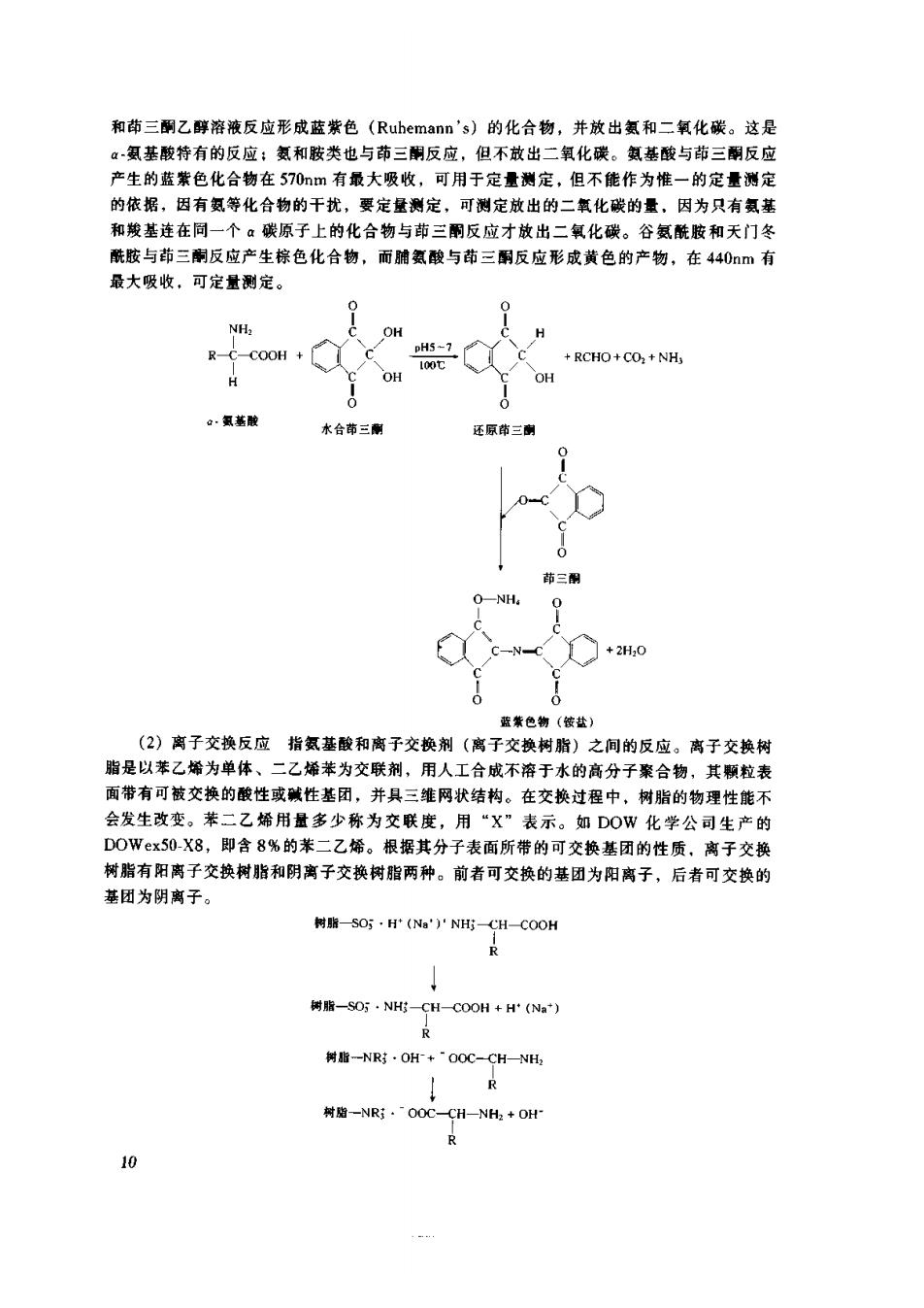
和苗三酮乙醉溶液反应形成蓝紫色(Ruhemann's)的化合物,并放出氨和二氧化碳。这是 。氨基酸特有的反应:氨和胺类也与茚三酮反应,但不放出二氧化碳。氨基酸与茚三酮反应 产生的蓝紫色化合物在570如m有最大吸收,可用于定量测定,但不能作为惟一的定量测定 的依据,因有氨等化合物的干扰,要定量测定,可测定放出的二氧化碳的量,因为只有氮基 和线基连在同一个:碳原子上的化合物与茚三酮反应才放出二氧化碳。谷氨酰胺和天门冬 酰胺与茚三酮反应产生棕色化合物,而脯氨酸与苗三酮反应形成黄色的产物,在440m有 最大吸收,可定量测定。 OH R-C-COOH pH5-7 100t +RCHO+CO]+NH OH OH ,氨基酸 水台市三 还原体三南 茚三翻 ONH 〔+20 蓝紫色物(策盐) (2)离子交换反应指氢基酸和离子交换剂(离子交换树脂)之间的反应。离子交换树 脂是以苯乙烯为单体、二乙烯苯为交联剂,用人工合成不溶于水的高分子案合物,其颗粒表 面带有可被交换的酸性或碱性基团,并具三维网状结构。在交换过程中,树脂的物理性能不 会发生改变。苯二乙烯用量多少称为交联度,用“X”表示。如D0W化学公司生产的 D0W©x50-X8,即含8%的*二乙烯。根据其分子表面所带的可交换基团的性质,离子交换 树脂有阳离子交换树脂和阴离子交换树脂两种。前者可交换的基团为阳离子,后者可交换的 基团为阴离子。 树脂SO;·F(Na')'NH一CH-COOH 寤-SO5·NH一CHC0H+H(N)) R 村-NR.OoC-CH-NH+0H

离子交换柱层析法常用于分高氨基酸。其基本原理是:在一定的H条件下,不同氨基 酸,由于等电点不同所带的净电荷不同,与离子交换树脂结合的能力不同。这样,就可根据 欲分离的氨基酸的性质,选择阳离子或阴离子交换树脂,与这些氨華酸反应。然后再选择一 定pH和离子强度的缓冲液进行洗脱,不同的氨基酸和树脂的结合能力不同,在洗脱过程中 将依次被从柱上洗出,达到相互分离的目的。 为了研究某一蛋白质的氨基酸组成,常把蛋白质样品进行水解,通过离子交换柱层析法 分析,可确定该种蛋白质分子中含有那些氨基酸。如果用自动分部收集仪定时收集洗脱液 结合茚三酮显色,在570nm或440nm波长(脯氨酸)测定,可定量测定该蛋白质中每种氨 基酸的含量。常用的水解蛋白质的方法有: ①酸水解常用6molL的盐酸。所用酸量一般是蛋白质的5~10倍:水解温度一般为 110-120℃,水解时间一般需要24h或更长。酸水解的优点:水解彻底,不产生消旋作用。 能使蛋白质全部转变为氨基酸;缺点,色氨酸完全被破坏,它与含醛基的化合物如塘类作用 生成一种黑色物质,称为腐黑质。其次,酸水解液中的谷氨酰胺(G)转变为谷氨酸 (Gu),天门冬酰胺(Asn)转变为天门冬氨酸(Asp)。含羟基的氨基酸,随着水解时间的 延长,都有不同程度的破坏。 ②碱水解多用4.2-5molL的氢氧化钠,有时也用4mol八的氢氧化银。 一般水解 温度为110℃,时间为24h。碱水解的优点是色氨酸不被跛坏,峡点是易发生外消旋作用, 即某一个氨基酸溶液中,该氨基酸的D和L型各占50%,莜此旋光性抵消,失去旋光性。 由于D型氨基酸不能被人体所利用,因而营养价值降低。该水解方法常用于蛋白质分子中 色氨酸的定量分析。 3,a氨基参与的反应 (1)成盐作用酸水解液中的氨基酸,多以氨基酸盐酸盐的形式存在 (2)亚硝酸反应这是α氨基所特有的反应。氨基酸与亚硝酸反应出氨,其中的 个氮来自氨基酸,另一个来自亚硝酸。该反应是Van Slyke氏氨基氮测定的理论基础。此反 应可用来判断蛋白质的水解程度,蛋白质水解愈完全,放出的氨基酸愈多,与亚硝酸反 应放出的氮愈多。 R-CH-COOH+HNO:-R-CH-COOH +N:t+H;o NH. (3)甲醛反应氢基酸既是酸又是碱,但不能直接用酸碱滴定法来测定其含量,因为它 的酸碱滴定的等当点pH过高或过低,没有适当的指示剂可用。如氨基酸的a氨基的pH值 为9.7左右,完全解离时,pH可达11或更高。在室温和pH中性条件下,甲整与氨基酸的 a氨基结合,生成羟甲基衍生物(H+一次放出),从而降低了氢基的碱性。可选择酚酞指示 剂(变色范围8.2~10),用氢氧化钠滴定放出的H·,因为每放出一个H,就相当于有一 个氨基氮,从氨基氮量可算出氨基酸的量。 R-CHCOOR- (CH.OH) ·羟甲基祈生物 二羟平蛋衍生物 (4)氨基酸与2,4-二硝基氟苯的反应在弱碱性(pH8~9)、暗处、室温或40℃条件 下,氢基酸和2,4.二硝基氟苯反应产生黄色的二硝基苯氨基酸(dinitrophenylamino acid