
了解愈来愈多,尤其是近0年来,许多蛋白质的结构也已搞清楚,这些知识都是对蛋白质 讲行科学分卷的基础。最合理的分类原则,应根据蛋白质的结构。但目前结构已知的蛋白质 的数目有限 而蛋白质的种类甚多,最简单的单细胞生物大肠杆菌, 每个菌体也含有大约 2000种以上的蛋白质。高等生物如人体内,侧含有十万种以上的蛋白质。整个生物界大约 有100亿种不同的蛋白质。目前常用的分类方法如下。 1.根据分子形状分类 蛋白质按其分子外形的对称程度可分为两类。 (1)球状蛋白质分子比较对称,接近球形或椭球形,溶解度较好,能结晶。大多数蛋 白质属于球状蛋白质。如血红蛋白、肌红蛋白、生物催化剂 、各种抗体等 (2)纤维状蛋白质分子对称性差,类似细棒状或纤维状,解性质不一。大多数不溶 于水,如胶原、角蛋白等。有的溶于水,如肌球蛋白、血纤维蛋白原等。 2.根据功能分类 20世纪70年代开始,根据蛋白质研究的进展,开始根据其功能分类。按功能可将蛋白 质分为两大类」 (1)活性蛋白质(active proten)如酶蛋白、转运蛋白、运动蛋白、保护和防御蛋白 激素蛋白、受体蛋白、背养和储存蛋白等,如卵清蛋白(ovalbumin),小麦种子中的醇溶蛋 白等,具有储存氨基酸的功能,用作有机体及其胚胎发育的原料。此外还有毒蛋白,指促人 机体可引起各种症状,甚至引起死亡的异体蛋白,即具有毒性的蛋白质,如蓖麻毒蛋白、相 思子毒蛋白、天花粉蛋白、白喉毒素(细茵毒蛋白)、蛋乱毒素(细菌毒蛋白)。蛇、蜜蜂和 蝎子的毒液中都含有毒蛋白。对毒蛋白的研究在抗癌药物的筛选中具有重要的意义,使选择 的药物能专一性地识别肿瘤细胞 是抗肿痛药物筛选的主攻方向。自1975年,发明了单克 隆技术后,人们设想能否在单抗上连按各种“弹头药物”,然后借助单抗的选择性使其结合 到肿瘤细胞表面,并将它们杀死。这就是人们常说的“导向药物”,如用蓖麻毒蛋白、相思 子蛋白、天花粉蛋白()等。所有这些“弹头” 毒素都能高效地抑制细胞的 蛋白质合成,从而导致细胞死亡。 (2)非活性蛋白(passive protein)有些蛋白质具有一定的功能,但主要对生物体起支 特和保护作用,谈不上有什么生物活性。故相对于活性蛋白来说,称它们为非活性蛋白,如 硬蛋白、角蛋白等。这类蛋白主要存在于结缔组织、带等。 3.根据组成分类 根据组成也可将蛋白质分为两类。 (1)简单蛋白质(simple protein)分子中只含氨基酸。 (2)结合蛋白质也称复合蛋白质(coj ted pr tein)或全蛋白质(holoprotein)。它 由简单蛋白质和非蛋白质部分结合而成 ,主要的结合蛋白有六种。 ①色蛋白(chromoprotein)蛋白质和某些色素物质结合而成。非蛋白质部分名为前红 素,故又称为血红素蛋白(hemoprotein)。血红素为卟啉类化合物,卟啉环中心含有金端, 如含铁的血红蛋白、细胞色素类 ,含镁离子(Mg·)的如叶绿蛋白,含铜离子的有血蓝蛋 自(hemocyanin)等。 ②金属蛋白(metalloprotein)直接与金属结合的蛋白质,如铁蛋白(ferritin)含铁 乙醉脱氢酶含锌,黄吟氧化酶合钼和铁等。 ③磷蛋白(phosphoprotein)分子中含降酸基,磷酸基一般与蛋白质分子中的丝氢酸 2

或苏氨酸通过酯健相连。如酪蛋白、胃蛋白酪等 ④核蛋白(nucleoprotein)非蛋白部分为核酸。核蛋白分布广泛,存在于所有的细胞中。 ⑤脂蛋白((lipoprotein)蛋白质和脂类结合构成脂蛋白,如卵黄球蛋白(lipovitellin) 凝血致活酶()等都是重的脂蛋白。在脂蛋白中,脂类和蛋白质之问以非力 价键结合。脂蛋白中的蛋白质部分称为脱辅基蛋白或载脂蛋白(apoprotein)。脂蛋白广泛分 布于细胞和血液中,因此将脂蛋白又分为细胞脂蛋白和血浆脂蛋白两类 a,细胞脂蛋白。它主要存在于生物膜(细胞膜和细胞器膜)。细胞指蛋白的蛋白质部分 常常又是糖蛋白,如红细胞细胞膜上的主要蛋白质为红血球膜糖肽(glycophorin),由131 个氨基酸组成,肽链上连有16个低聚籍单位。脂蛋白中的脂类主要是璃脂,其次为糖脂。 b,血浆脂蛋白。血浆脂蛋白又称为可溶性脂蛋白,在水中部分溶解,主要含有三酰基 甘油、胆固醇及其酯、晚脂和载脂蛋白四种成分。不同的血浆脂蛋白所含有的这四种成分的 此例不同。不同血浆脂蛋白由于所含的载脂蛋白不同,分子大小及所带的净电荷不同,在电 场中的迁移率不同。根据血浆脂蛋白在电场中的迁移情况,可分为á脂蛋白和β脂蛋白两大 类。根据超速离心法,血浆脂蛋白还可分为:乳摩微粒(chylomicron,CM),高密度脂蛋 白、低密度脂蛋白和极低密度脂蛋白四种(表11)。 表11血脂蛋白的种类和基本成分/% 组成 甘油三倒 胆困胖及其宿 南甜 置白质 W蛋白(VDL 1d-1g 10-20 8-12 高密成蛋自HDL言 1217 2225 0 低密度数蛋白(LDL》 8-10 15-27 28-30 21 ⑥糖蛋白(gy coprotin)蛋白质和糖类结合构成糖蛋白。糖蛋白广泛存在于动物、植 物、真超、细菌及病毒中。糖蛋白的相对分子质量大小悬殊,糖含量一般占1%一85%。在 糖蛋白中,蛋白质部分和糖之戒以共价键结合。糖蛋白中的糖一般为低聚糖(<15个糖单 ,低聚糖中糖分子的数目相差较大,有的为二糖,如胶原蛋白中;多数为低聚糖。个别 的糖蛋白中所含的糖基多达100个以上,如动物领下腺糖蛋白。 根据糖蛋白分子中所含的氨基己糖含量的不同,习惯上把糖蛋白分为粘蛋白(mu©o protein)(含氢基己糖在4%以上)和糖蛋白(含氨基己糖在4%以下)。蛋白多糖(prote glycan),也是一种糖蛋白,存在于多种组织和体液中,但含糖量比一般糖蛋白高(可达 95%),故实为含蛋白的多糖。血浆中的各种球蛋白,如a球蛋白、B和y球蛋白,纤维蛋 白原等都是糖蛋白。胎甲球蛋白(胎球蛋白)(fein),在胎儿和新生儿肝中存在, 也是 种糖蛋白,成年人血清中若出现该种蛋白,可基本上诊断为肝瘧。 糖蛋白具重要的生物学功能。可作为机体内外表面的保护物及润滑剂;如鱼类体表面的 粘液含丰富的糖蛋白,有防止在不利的条件下水分丧失的作用。动物消化道,呼吸谊等体 含有的塘蛋白,有助于物质运输并保护休腔不受机械损伤,关节滑液中的糖蛋白起润滑作 用。糖蛋白充当一些物质(如维生素,激素)的载体,常与它们结合,有助于这些物质在体 内的转移和分配等。 4.根据溶解度的不同分类 根据溶解度的不同,可将蛋白质分溪如下几种 3

(I)清蛋白(albumin)又称白蛋白。在自然界分布广泛;清蛋白溶于水、中性盐类 稀酸和稀碱,可被饱和硫酸铵沉淀。清蛋白含甘氨酸少 血清清蛋白几乎不含甘氯酸 (2)球蛋白在生物界广泛存在,具重要的功能。有两类球蛋白: ⑦拟球蛋百(假球蛋白)(pseudoglobulins),溶于水。 ②优球蛋白(euglobulins),不溶于水,但溶于稀盐溶液中 球蛋白可被半饱和的硫酸铵沉淀,一般含3.5%的甘氨酸。如血清球蛋白、肌球蛋白 植物种子球蛋白等。 3)组蛋白(histones) 组蛋白是染色体的结构蛋白,含精氨酸和赖氨酸多所以呈碱 性。在进化上,组蛋白高度保守,无组织特异性。胸腺和胰腺中含组蛋白多。 (4)精蛋白(protamines)是一类分子量较小的酸性蛋白质,存在于成熟的精细胞中 含碱性氨基酸,特别是精氨酸多,分子量小,易溶于水、稀酸中, 如鲑精蛋白。 (5)醇溶蛋白(prolamines)醇溶蛋白溶于70%一80%的乙醇,多存在于禾本科植物的 种子,特别是种子的外皮中,如玉米蛋白等。 (6)硬蛋白类()主要存在于皮肤、毛发、指甲等,起支持和保护作用 在稀酸、稀碱、水和盐溶液中均不溶。如角蛋白、胶原蛋白、弹性蛋白和丝蛋白等。丝蛋白 多由昆虫的丝囊腺所分泌,刚分泌出来时为液体,遇空气则硬化,它是丝纤维的主要成分。 (7)谷蛋白类(glutelins) 主要存在于谷类作物中 不溶于水 中性盐和醇溶液,但溶 于稀酸和稀碱。如麦蛋白、米蛋白等。 5,根据营养价值不同分类 ()完全蛋白质含有人体所必需的各种氨基酸 (2)不先全蛋白质缺乏人体所必需的某种氨基酸。如植物蛋白所含有的必需氨基酸与 人体蛋白质有较大的差异。大豆蛋白中缺乏蛋氨酸,小麦蛋白中缺乏赖氨酸,玉米蛋白中缺 乏色氨酸等。如果把缺乏甲种氨基酸的蛋白质和缺乏乙种氨基酸的蛋白质适当配合使用,可 获得最高的蛋白质利用率。实验证明,如果单吃玉米和大豆,蛋白质的利用率分别是60% 和64%;如果把两者按3:1的比例混合使用,混合食物蛋白质的利用率可达到76%。将不 同来源的蛋白质混合食用,以提高蛋白质的生理价值的作用称为蛋白质的互补作用。 三、蛋白质的元素组成 蛋白质的元素组成是指蛋白质分子中所含的各种元素的多少,蛋白质不论其来源如问 各种蛋白质的元素组成很近似:所含的主要元素有 碳(50%一55%),平均52%: 氢(6.9%-7.7%),平均7%: 氧(21%-24%),平均23%: 氮(15%-17.6%),平均16%: (0.3%一2.3%),平均2% 除此之外,不同种类的蛋白质中尚含有少量的其他元素,这些称为微量元素。蛋白质中 所含的微量元素主要有: 骑(0.4%~0.9%)、平均0.6%如酪蛋白中含磷: 铁(0,4%一0.9%),动物肝脏是含铁丰富的食物; 费,主要存在于甲状腺球蛋白中。此外还有锌,铜等 相对于糖和脂来说,蛋白质元素组成的特点是一切蛋白质都含有氯元素,且比较恒定 平均为16%。而糖、脂多不含氮,即使含氮,其量也甚徽,且不恒定。 既然蛋白质中含氯量平均为16%,那么任何生物样品中每克蛋白氢的存在,大约表示

该样品中含有100/16=6.25g蛋白质,6.25常称为蛋白质系数。若能测出样品的总氮量和 非蛋白氨量,总氨量减去非蛋白氨量等于蛋白氮量(PN),蛋白氮量乘以蛋白质系数 (6.25)即得某样品中的蛋白质含量。 第二节蛋白质的组成单位氨基酸 18I9年,法国化学家布拉孔诺(H~Braconnot)把纤维素放在酸里加热,成功地把纤维 素水解为葡萄糖,从而知道纤维素是由许许多多的葡萄糖“手拉手”组成的,因此他想,能 不能像研究纤维素那样来研究蛋白质的组成呢?首先他把明胶放在酸里加热,结果从酸水解 液中分离到一种分子量比蛋白质小得多的含氮化合物,后来取名为甘氨酸;他又用同样方法 从肌肉水解液中提取出另一种含氨化合物,因它的结构中含氨基和羧基,故取名为氨基酸。 现已确证蛋白质的基本组成单位是氨基酸。 一、氯基酸的一般结构特征 目前,已发现的氨基酸很多,但组成蛋白质分子的氨基酸只有20种左右。这20种氨基 酸也称为编码氨基酸,因为遗传密码表中只有这20种氨基酸的密码。这20种氮基酸中,有 19种(除脯氨酸外)具有下列的结构: NH:-CH-COOH 故组成蛋白质的氨基酸,除R基团不同外,其分子中均含有氨基和羧基,且氯基和羧 基都连在同一个a碳原子上,故称为α氨基酸;自由存在的氨基酸中,也有B氨基酸,如 日丙氨酸,但是蛋白质分子中的氨基酸均为。:氨基酸 当R不等于H时,氨基酸分子中都含有不对称碳原子,因此有D-型和L型两种异构 体;D和L氨基酸在化学性质、熔点、溶解度等性质方面没有区别,但生理功能完全不同: D型氨基酸一般不能被人和动物利用。蛋白质分子中的氨基酸一般为L型的。D和L型氨 基酸是以甘油醛或乳酸为参考标准。 CHO OH HO-C-H CHOH D.甘醛 D基酸,L基酸和D甘油酷、L甘油的结构对啊 二、氯基酸的分类和结构 (1)根据氢基酸分子中所含氨基和羧基数目的不同,可将组成蛋白质的20种氨基酸分 为三大类: 1)中性氮基酸。分子中含-个氢基。一个骏某 2)酸性氨基酸,分子中含一个氨基,两个羧基 3)碱性氨基酸,分子中含一个羧基,两个氨基。 (2)根据氨基酸和羧酸的关系,氢基酸可分为: 5
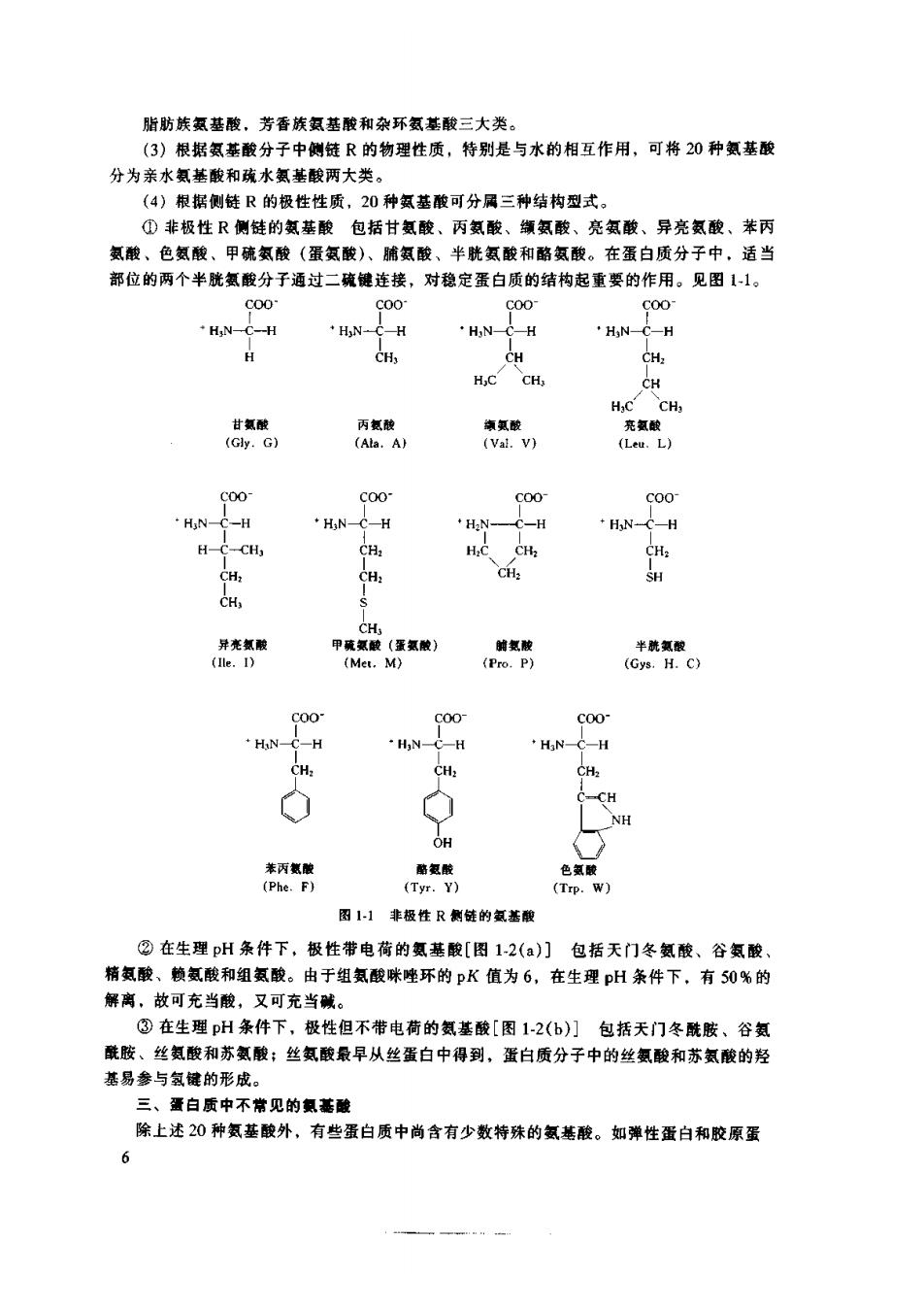
脂肪族氨基酸,芳香族氨基酸和杂环氨基酸三大类。 (3)根据氢基酸分子中侧链R的物理性质,特别是与水的相互作用,可将20种氨基酸 分为亲水氨基酸和疏水氨基酸两大类。 (4)根据侧链R的极性性质,20种氨基酸可分属三种结构应式。 ①非极性R侧链的氨基酸包括甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、苯丙 氨酸、色氨酸、甲硫氨酸(蛋氨酸)、脯氨酸、半胱氨酸和酪氨酸。在蛋白质分子中,适当 部位的两个半胱氨酸分子通过二硫健连接,对稳定蛋白质的结构起重要的作用。见图11。 S00 H,N- HN-C-H HNCH H3N-C-H CH CH CH, HC CH, c 丙氮酸 氯酸 亮 (Ata.A) (Val.V) (Leu.L) 00 C00 C00 ·HN -H ·HNCH ·HeN- -C-H ◆HN-CH -CH H.C CH 2老 (Mer. Coo HN-C-H HN-C-H HN- -H CH. H NH OH 新 氢酸 色酸 (Tyr.Y) (Trp.W) 图1非极性R侧链的氨基酸 ②在生理pH条件下,极性带电荷的氨基酸[图12(a)门包括天门冬氨酸、谷氨酸 精氨酸、赖氨酸和组氨酸。由于组氨酸睐唑环的pK值为6,在生理pH条件下,有0%的 解离,故可充当酸,又可充当碱。 ③在生理pH条件下,极性但不带电荷的氨基酸[图1-2(b)】包括天门冬酰胺、谷氨 酰胺、丝氨酸和苏氨酸;丝氨酸最早从丝蛋白中得到,蛋白质分子中的丝氨酸和苏氨酸的羟 基易参与氢键的形成。 三、蛋白质中不常见的氨酸 除上述20种氨基酸外,有些蛋白质中尚含有少数特殊的氢基酸。如弹性蛋白和胶原蛋 6