
3.沸点: 1)一般规律 C数↑,bpt 正构的>异构的 2)醇的沸点比分子量相近的烃、卤代烃、 醚及醛酮高。(通过氢键使分子缔合) 3)-OH数目多,bp高。 16
16 3. 沸点: 3) -OH数目多,bp 高 。 1) 一般规律 C数↑,bp ↑ 正构的>异构的 2) 醇的沸点比分子量相近的烃、卤代烃、 醚及醛酮高。(通过氢键使分子缔合)
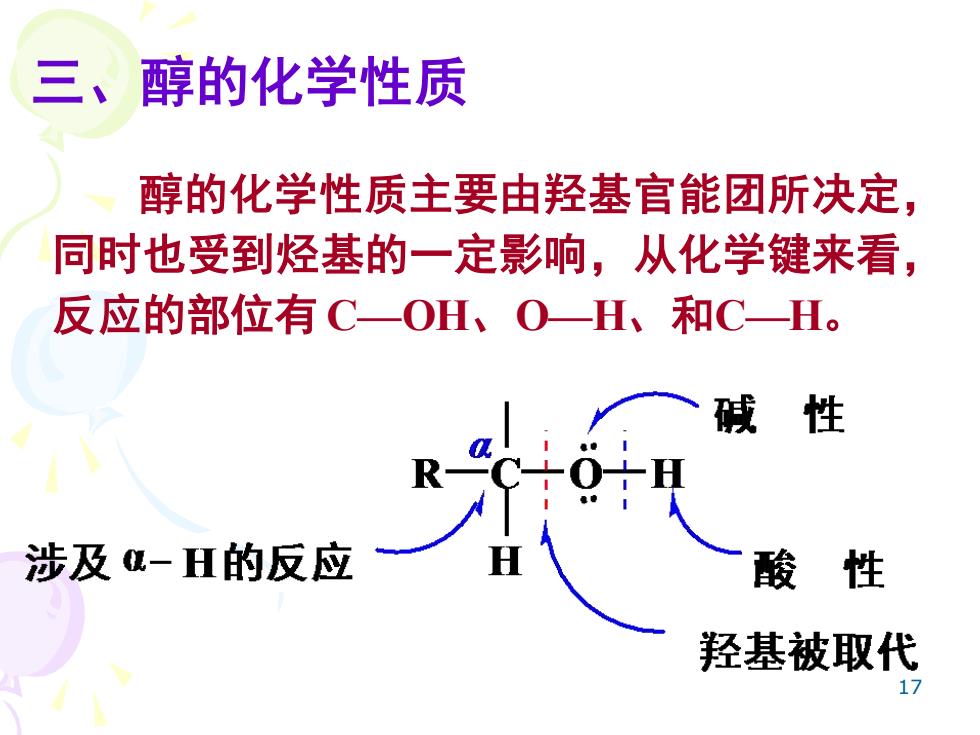
三、醇的化学性质 醇的化学性质主要由羟基官能团所决定, 同时也受到烃基的一定影响,从化学键来看, 反应的部位有C一OH、O一H、和C一H。 碱 性 涉及-H的反应 酸性 羟基被取代
17 三、醇的化学性质 醇的化学性质主要由羟基官能团所决定, 同时也受到烃基的一定影响,从化学键来看, 反应的部位有 C—OH、O—H、和C—H
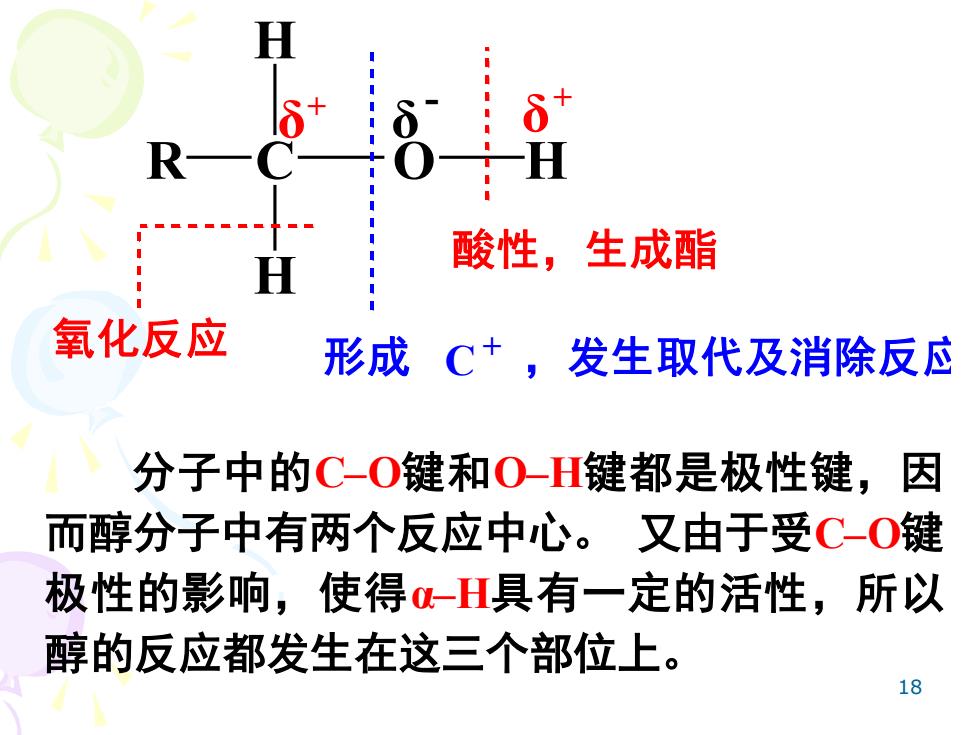
酸性,生成酯 氧化反应 形成C+,发生取代及消除反应 分子中的C-O键和O-H键都是极性键,因 而醇分子中有两个反应中心。又由于受C-O键 极性的影响,使得α-H具有一定的活性,所以 醇的反应都发生在这三个部位上。 18
18 R C O H H H 酸性,生成酯 氧化反应 形成 C + ,发生取代及消除反应 δ + δ δ - + 分子中的C–O键和O–H键都是极性键,因 而醇分子中有两个反应中心。 又由于受C–O键 极性的影响,使得α–H具有一定的活性,所以 醇的反应都发生在这三个部位上

(一)醇与金属钠的反应(酸性) 2H2O+Na→NaOH+H21 HO) 2R-OH+2Na 无水 →2RONa+H21 RO) CH3CH2ONa +H-OH-NaOH+CH3CH2OH 醇的酸性一般比水还弱,其酸性只有在无水 条件下被活泼金属置换才能表现出来。Na与醇 的反应比与水的反应缓慢的多,反应所生成的热 量不足以使氢气自燃,故常利用醇与Na的反应销 毁残余的金属钠,而不发生燃烧和爆炸。 19
19 (一)醇与金属钠的反应(酸性) 2R-OH + 2Na 2RONa + H2 无水 CH3CH2ONa +H OH NaOH+ CH3CH2OH 2H2O + Na NaOH + H2 醇的酸性一般比水还弱,其酸性只有在无水 条件下被活泼金属置换才能表现出来。 Na与醇 的反应比与水的反应缓慢的多,反应所生成的热 量不足以使氢气自燃,故常利用醇与Na的反应销 毁残余的金属钠,而不发生燃烧和爆炸。 (HO- ) (RO- )
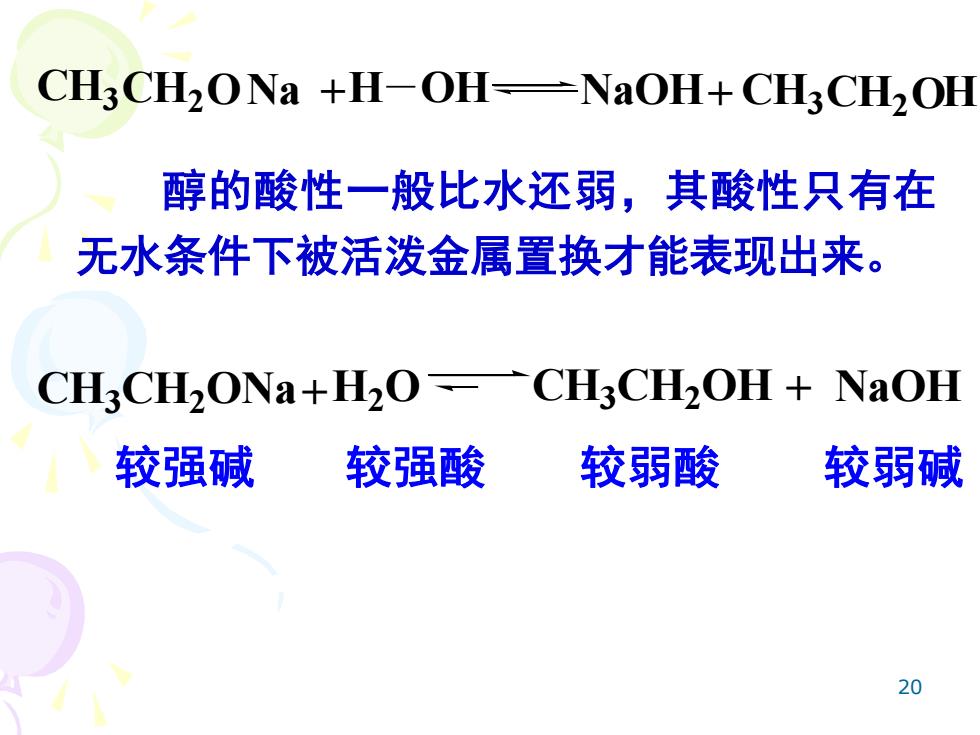
CH3CH2ONa +H-OH-NaOH+CH3CH2OH 醇的酸性一般比水还弱,其酸性只有在 无水条件下被活泼金属置换才能表现出来。 CH3CH2ONa+H2OCH3CH2OH+NaOH 较强碱 较强酸 较弱酸 较弱碱 20
20 CH3CH2ONa +H OH NaOH+ CH3CH2OH 醇的酸性一般比水还弱,其酸性只有在 无水条件下被活泼金属置换才能表现出来。 较强碱 较强酸 较弱酸 较弱碱 CH3CH2ONa+H2O CH3CH2OH + NaOH