
溶液的吸附作用和液体表面张力的测定 京化工 大弹 主讲教师:张丽丹教授 北京化工大学化学实治教学示克中心
溶液的吸附作用和液体表面张力的测定 北京化工大学化学实验教学示范中心 主讲教师: 张丽丹 教授

实验目的 北京化工大学 化学实验教学中心 1.用最大泡压法测定不同浓度的表面活性物质(正丁醇) 溶液在一定温度下的表面张力; 2.应用Gibbs7和Langmuir吸附方程式进行精确作图和图解 微分,计算不同浓度正丁醇溶液的表面吸附量和正丁醇 分子截面积,以加深对溶液吸附理论的理解; 3.掌握作图法的要点,提高作图水平
一、实验目的 1.用最大泡压法测定不同浓度的表面活性物质(正丁醇) 溶液在一定温度下的表面张力; 2.应用Gibbs和Langmuir吸附方程式进行精确作图和图解 微分,计算不同浓度正丁醇溶液的表面吸附量和正丁醇 分子截面积,以加深对溶液吸附理论的理解; 3.掌握作图法的要点,提高作图水平。 北京化工大学 化学实验教学中心

二、实验原理 北章化工大学 化学实验教学中心 Gibbs/用热力学方法导出了一定温度下,吸附量的定量 公式 Gibbsp吸附等温式: r=- c dy RT dc 式中,厂为表面吸附量(mol/m);y为表面张力N/m或J/m2); T为热力学温度(K);c为溶液本体的平衡浓度(ol/L);R为 气体常数[J/(moK)]
二、实验原理 Gibbs用热力学方法导出了一定温度下,吸附量的定量 公式——Gibbs吸附等温式: 北京化工大学 化学实验教学中心 式中,Γ为表面吸附量(mol/m2 );γ为表面张力(N/m或J/m2 ); T 为热力学温度(K);c为溶液本体的平衡浓度(mol/L);R为 气体常数[J/(mol·K)]

二、实验原理 北京化工大学 化学实验教学中心 设气-固单分子层吸附的Langmuir吸附等温式适用于溶 液的表面吸附,并以表面吸附量(表面超量)代替单位表面 上所含正丁醇的物质量,则有: T Kc 0= 。1+KC 或 r-D T 式中,为吸附分数;c为溶液本体平衡浓度;K为与溶液表 面吸附有关的经验常数。由cT~c作图可得一直线,有直线 斜率求,由如下公式可求分子的截面积S。 S=. 1 W。 式中,N为Avgodro常数
二、实验原理 设气-固单分子层吸附的Langmuir吸附等温式适用于溶 液的表面吸附,并以表面吸附量(表面超量)代替单位表面 上所含正丁醇的物质量,则有: 或 北京化工大学 化学实验教学中心 式中,θ为吸附分数;c为溶液本体平衡浓度;K为与溶液表 面吸附有关的经验常数。由c/Γ~c作图可得一直线,有直线 斜率求Γ∞,由如下公式可求分子的截面积S。 0 1 S N = 式中,N0为Avgodro常数
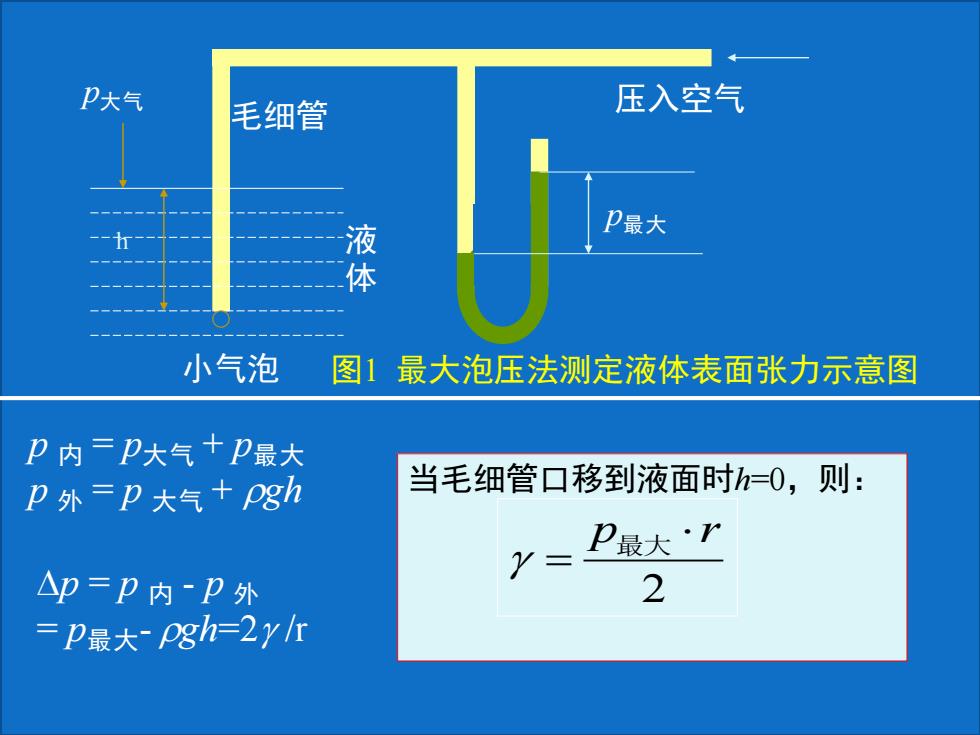
P大 毛细管 压入空气 液 P最大 体 小气泡 图1最大泡压法测定液体表面张力示意图 卫内=P大气+P最大 P外=p大气+gh 当毛细管口移到液面时h=O,则: Y= P最大·r △p=P内P外 2 =P最大Pgh=2y1
压入空气 毛细管 液 体 小气泡 p大气 p最大 h 图1 最大泡压法测定液体表面张力示意图 p 内 = p大气 + p最大 p 外 = p 大气 + gh p = p 内 - p 外 = p最大- gh=2 /r 当毛细管口移到液面时h=0,则: 2 p r = 最大