
可逆电池电动势的测定 主讲:吕志 北京化工大学化学实验教学示范中心
主讲:吕 志 北京化工大学化学实验教学示范中心

一.实验目的 北京化工大学 化学实验教学中心 1.理解对消法(补偿法)测定原电池电动势的基本原理; 2.掌握电极制作方法; 3.掌握电位差计的操作方法,准确测定电池电动势
一.实验目的 1. 理解对消法(补偿法)测定原电池电动势的基本原理; 2. 掌握电极制作方法; 3. 掌握电位差计的操作方法,准确测定电池电动势。 北京化工大学 化学实验教学中心

二.实验原理 北京化工大学 化学实验教学中心 实验内容 测下列电池电动势: 1.Hg0Hg2CL2(s)KC(饱和)CuSO4(0.1moL)Cu(s) 2.Zn(s)ZnSO,(0.1molL)KC饱和)Hg2CL2(sHg④ 3.Zn(s)ZnSO(0.1moVL)CuSO(0.1moV/L)Cu(s) 4.Hg0HgC12(S)KC(饱和)Q-H,Q(用待测溶液饱和Pts) 求: (1)铜电极的标准电极电势: (2)锌电极的标准电极电势; (3)丹尼尔电池的标准电动势: (4)待测溶液的pH
二.实验原理 北京化工大学 化学实验教学中心 实验内容 Hg(l) Hg Cl (s)KCl(饱和) CuSO (0.1mol/L) Cu(s) 2 2 4 Zn(s) ZnSO (0.1mol/L) KCl(饱和)Hg Cl (s) Hg(l) 4 2 2 Zn(s) ZnSO (0.1mol/L) CuSO (0.1mol/L) Cu(s) 4 4 Hg(l) Hg Cl (s) KCl(饱和) Q H Q( 饱和)Pt(s) 2 2 − 2 用待测溶液 1. 2. 3. 4. 测下列电池电动势: 求:(1)铜电极的标准电极电势; (2)锌电极的标准电极电势; (3)丹尼尔电池的标准电动势; (4)待测溶液的pH

二.实验原理 北奈化工大学 化学实验教学中心 1.铜电极的标准电极电势: E8u=E,+EH球 2.303R7 2F lg acu 2.锌电极的标准电极电势: %m=E汞-E, 2.303RT 2F lg an 3.丹尼尔电池的标准电动势: 明E=8F号2=6+23037电 2F 4.待测溶液的p pH=品-FtE-E 2.303RT/F
二.实验原理 北京化工大学 化学实验教学中心 1.铜电极的标准电极电势: 2.锌电极的标准电极电势: 3.丹尼尔电池的标准电动势: 4.待测溶液的pH: 2+ = + − 2+ Cu /Cu 1 Cu lg 2 2.303 F RT E E E甘汞 2+ = − − 2+ Zn /Zn 2 Zn lg 2 2.303 F RT E E甘汞 E + + = + − + = + 2 2 2 2 Cu Zn Cu /Cu Zn /Zn 3 lg 2 2.303 F RT E E E E 丹尼尔 RT F E E E 2.303 / pH Q/HQ − − 4 = 甘汞
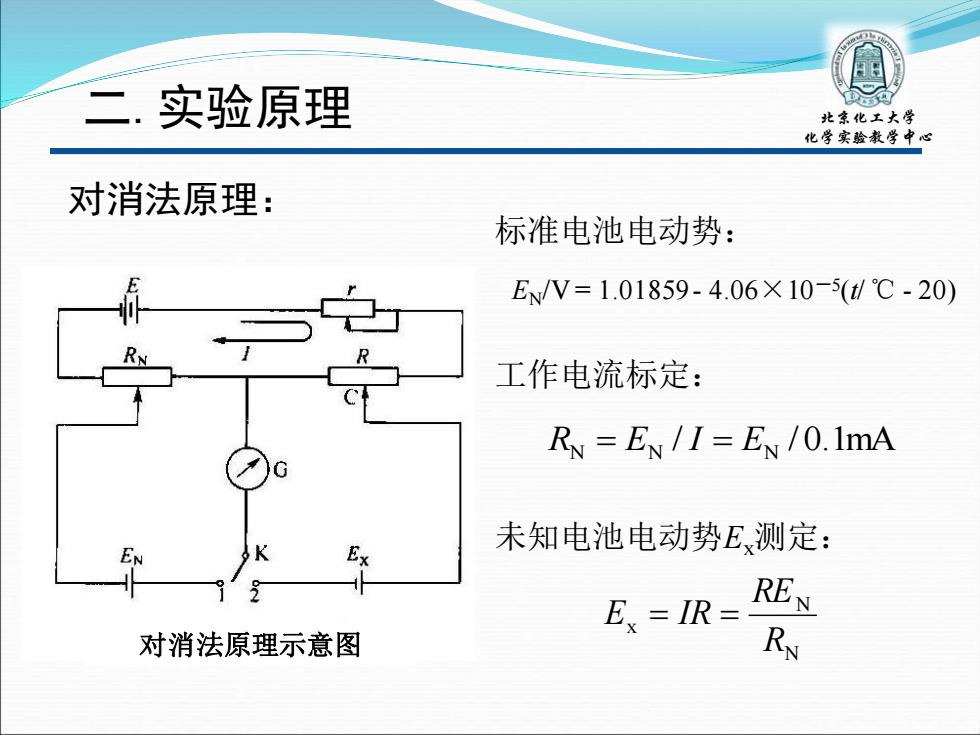
二.实验原理 北京化工大学 化学实验教学中心 对消法原理: 标准电池电动势: E/V=1.01859-4.06×10-5(t/℃-20) 工作电流标定: Ry =EN /I=EN /0.1mA 未知电池电动势E测定: E=IR= REN 对消法原理示意图 RN
二.实验原理 北京化工大学 化学实验教学中心 对消法原理: 对消法原理示意图 EN/V = 1.01859 - 4.06×10-5 (t/ ℃ - 20) 标准电池电动势: RN = EN / I = EN / 0.1mA 工作电流标定: N N x R RE E = IR = 未知电池电动势Ex测定: