
实验二十六硫酸铜的提纯及组成分析 一、实验目的 1.巩周化学实验的基本操作:溶解、搅拌、加热、过滤、蒸发、结品、抽滤等。 2.掌餐可溶性物质的重结品提纯方法。 3.学会Na影S:(O方标准溶液的配制及标定。 4.掌探间接碘址法测定CS()1的基本原理、操作条件和误差来源 5.初步学会722型分光光度计的使用 6。学会川标准曲线法进行试样中铁杂质含量测定的方法。 7.了解差热分析研究CuS(),·5H2(0受热脱水的原理和方法 二、实验原理 利用不同物质在同一种溶剂中的溶解度不同的性质,可将含有不溶性杂质和可溶性杂质 的物质提纯。粗硫酸铜(胆矾CuS(),·5Hz(O)中含有不溶性杂质和可溶性杂质,其中可希 性杂质中以Fe2:,Fe-[如下eS(4,Fe(S()1)3等]对硫酸铜的品质影响较大,并且含址 也较高 提纯操作中,先将粗CuS),·5H2O溶于热水中,用氧化剂H(将Fc氧化为Fe 后、测节溶液的pH值4,使F水解为F(OI)沉淀,趋热过滤,以除去不浴性杂质 然后,蒸发浓缩所得的滤液,使CuS),·5H()结品出来。其他微计可溶性杂质在硫酸铜线 品时,因为量比较少,尚处于未饱和状态。故仍留在母液中,当将其抽滤时,就可以得到较 纯的硫酸铜品体 上面这种物质的提纯方法叫重结品法 此法适合提纯在某一溶剂中不同温度下溶解度变 化较大的物质。欲得更纯的晶体可以多次重结品。 本实验采用沉淀分离法和重结品法结合,将硫酸铜提纯。有关分离部分的反应式为: 2FeS()+H2():+HzSO-Fez (S()x+2H2O e1·+3H,()+Fc(()H)+3H+ 控制pH值约为4的原因如下:由于液中的Fe,Fe2,Cu2~水解时均可生成氧氧 化物沉淀,但这些氢氧化物[Fe(OH)z,Fe()H)·Cu()H):]的沉淀条件是不同的。根 据沉淀理论,它们产生沉淀和完全沉淀所需要的(OH~浓度(即pH值)是不同的。当pH 4时,Fe2+,Cu2+均不发生沉淀,而F+已完全沉淀。为了使Fe2+也被除去,可以将其氧 化成Fe (二)碘量法测钢含量 间接碘量法使用的滴定剂是Na:S2(方标准溶液,面NS(固体试剂都含有少址杂 质,面且Na2S2()易风化、潮解,因此不能直接配制其标准溶液,只能先配制成接近需要 的浓度的标准溶液,然后再进一步标定出其准确浓度。 标定NaS2(O标准溶液的基准物有K:CrOh、KIO,和KBr(O等这些基准物在酸性 溶液巾均能与KI作用析出碘,如K2C:(h与KI的反应: Cr2(房+61-+14H+---2Cr3·+312+7H2() 析出的2可用NaS(O,标准溶液滴定:

12+2S20号-=2Ir+S(0g 标定时应注意控制的条件是 L.开始滴定的酸度以0.8~1.0mol/LHC为宜,酸度高可提高反应速率,但太高1易 被空气氧化,遣成较大的标定误差。 2.由于KCr2O,与KI的反应速率较慢,故应在暗处放置一定时间,再用N2S2()标 准溶液滴定。若以KIO3为基准物标定NaSO溶液则不必。 ·标定时以淀粉溶液作为指示剂,但加人不宜过早,应先用Na2S,O溶液滴定至溶液 呈淡黄色时,再加入淀粉溶液,用NSO溶液继续滴定到蓝色恰好消失,即为终点。淀 粉指示剂加人太早,大量的12与淀粉结合成蓝色物质,这部分磺不易与N?SO反应。 将提纯后的硫酸铜试样溶解于水中,加入H2S),和过量的K1溶液,铜离子与过量KI 作用,释出等量的碘,用NSO标准溶液滴定释出的碘,即可求出锅含址。 反应式为: 2Cu2++41--2Cul↓+12 12+252(0月—21+5(0g 加入过量K1,Cu+的还原趋于完全。山于Cul沉淀强刻地吸附2,使测定结果偏低,故在 滴定近终点时,加人适量KCNS。 使Cul(Ke=1.1×10-2)转化为溶解度更小的CuSCN (Ke=4,8×10B),释放出被吸附的12,反应生成的又可利用,可以使用较少的K1而 使反应进行得更完全。 CuI+SN·w-uSCN↓+I SCN只能在近终点时加人。香则有可能直接还原一价铜离子,使结果偏低 6Cu2++7SCN+4H20 -6CUSCN+SO +HCN+7H 也可避免有少量的12被CNS还原。 溶液的pH值应控制在3.3一4.0范围内,若pH值高于4,二价铜离子发生水解,使反 应不完全,结果偏低,而且反应速率慢,终点拖长:酸度过高,期】被空气中的氧氧化为 (Cu 化此反应 使结果偏高 Fe3+能氧化I析出,可用NH,HF2掩蔽,NH,HF2又是缓冲剂,使溶液pH值保 持在3.3一4.0. (三)分光光度法测定硫酸钢中铁舍量 在稀酸性溶液中,下+与CNS生成红色配合物溶液 Fe+nCNS→[Fc(CNS),] 血红色 Fe3+浓度越大,红色越深。 当一束波长一定的单色光通过有色溶液时,被吸收的分光和溶液的浓度,溶液的厚度及 人射光的强度等因素有关。 为溶液的浓度:b为溶液的厚度:16为入射光的强度1为透过溶液后光的强度。 根据实验证明:有色溶液对光的吸收程度与溶液中有色物质的浓度和液层厚度的乘积成 正比,这就是朗伯比尔定律,其数学表达式为: 1g(lo/I)=ebe 式中,1g(16/)表示光线通过溶液时被吸收的程度,称为“吸光度”,也叫“光密度”或“消 光度”e是一个带量,称为吸光系数。如将R(1)用A表示,划上式可以写成: A-Eb 因此,当b一定时,吸光度A和溶液浓度c呈直线关系
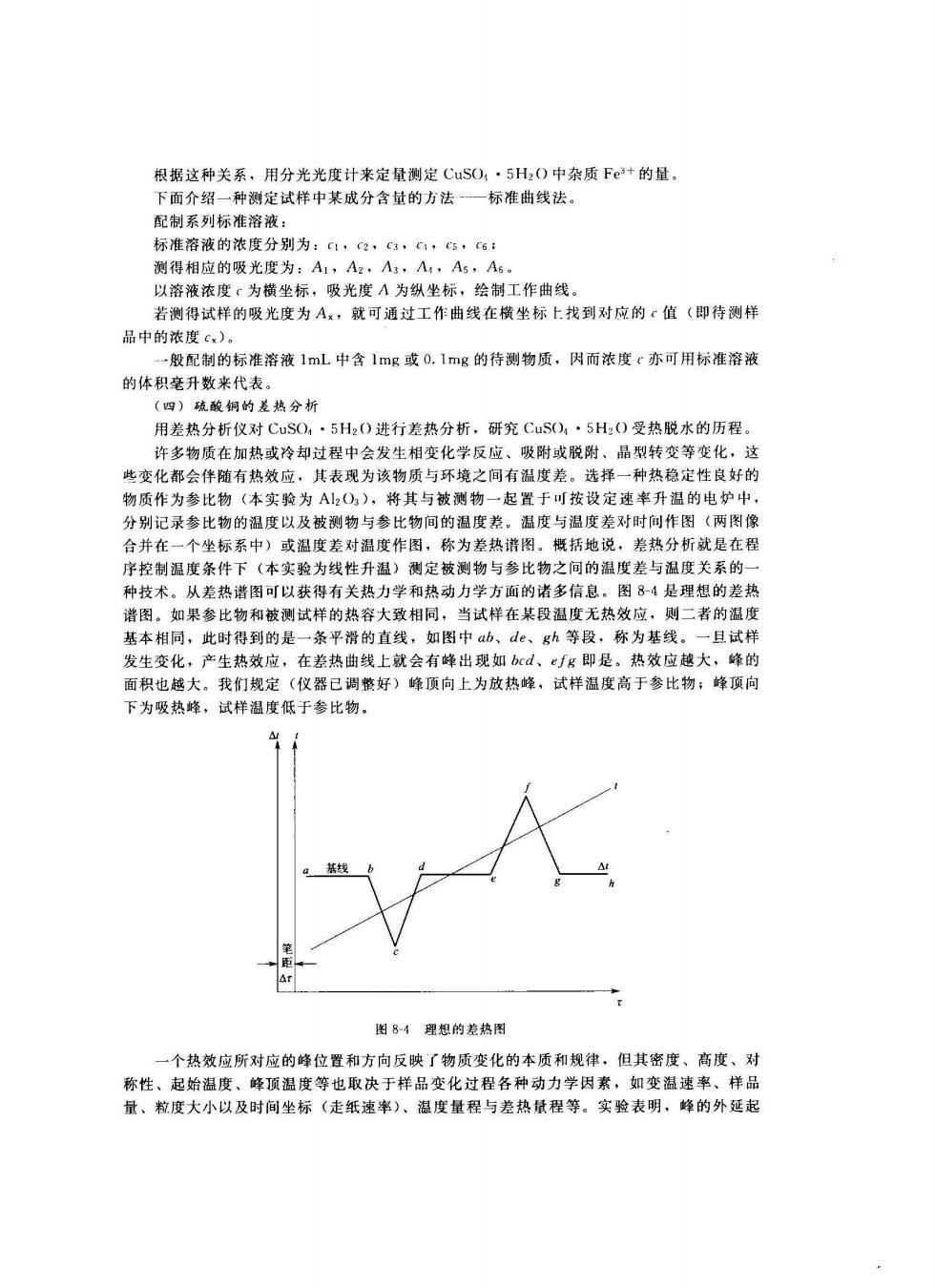
根据这种关系,用分光光度计来定量测定CuS(,·5H2O中杂质Fe+的量。 下面介绍一种测定试样中某成分含量的方法一标准曲线法。 配制系列标准溶液: 标准溶液的浓度分别为:c:,C2,c4。c1,C5,c6 测得相应的吸光度为:A1,A2,A,八,A5,A5 以溶液浓度:为横坐标,吸光度人为纵坐标,绘工作曲线 若测得试 的吸光度为Ax,就可通过工作曲线在横坐标上找到对应的值(即待测样 品中的浓度c,) 一般配制的标准溶液1mL中含1mg或0.1mg的待测物质,因而浓度c亦可用标准溶液 的体积毫升数来代表。 (四)硫酸铜的差热分折 用差热分析仪对CuSO,·5Hz(O进行差热分析,研究CuS(),·5H2()受热脱水的历程。 许多物质在加执或挎知过程中会发生相变化学反应、吸附或脱附,品型转变等变化,这 其表现为该物质与环境之间有温度差。选择一种热稳定性良好的 本3 北与被 于可按设 定速率升温 的电的中 分别记录参比物的温度以及被测物与参比物间的湿度老。温度与温 差对时 作 (两图像 合并在一个坐标系中)或温度差对温度作图,称为差热谱图。概括地说,差热分析就是在程 序控制温度条件下(木实羚为线性升温)测定被测物与参比物之间的温度差与温度关系的 种技术。从差热谱图可以获得有关热力学和热动力学方面的诸多信息。图8-4是理想的差热 谱图。如果参比物和被测试样的热容大致相同,当试样在某段温度无热效应,则二者的温度 基本相同,此时得到的是一条平滑的直线,如图中ab、d、gh等段,称为基线。一旦试样 发生变化,产生热效应,在差热曲线上就会有峰出现如bd、g即是。热效应越大,的 面积也越大 我们规定(仪器已调好)峰顶向上为放热峰,试样湿度高于参比物;峰顶向 下为吸热峰,试样温度低于参比物。 4 图84理想的差热图 一个热效应所对应的峰位置和方向反映了物质变化的本质和规律,但其密度、高度、对 称性、起始温度、峰顶温度等也取决于样品变化过程各种动力学因素,如变温速率、样品 量、粒度大小以及时间坐标(走纸速率)、温度量程与差热量程等。实验表明、峰的外延起
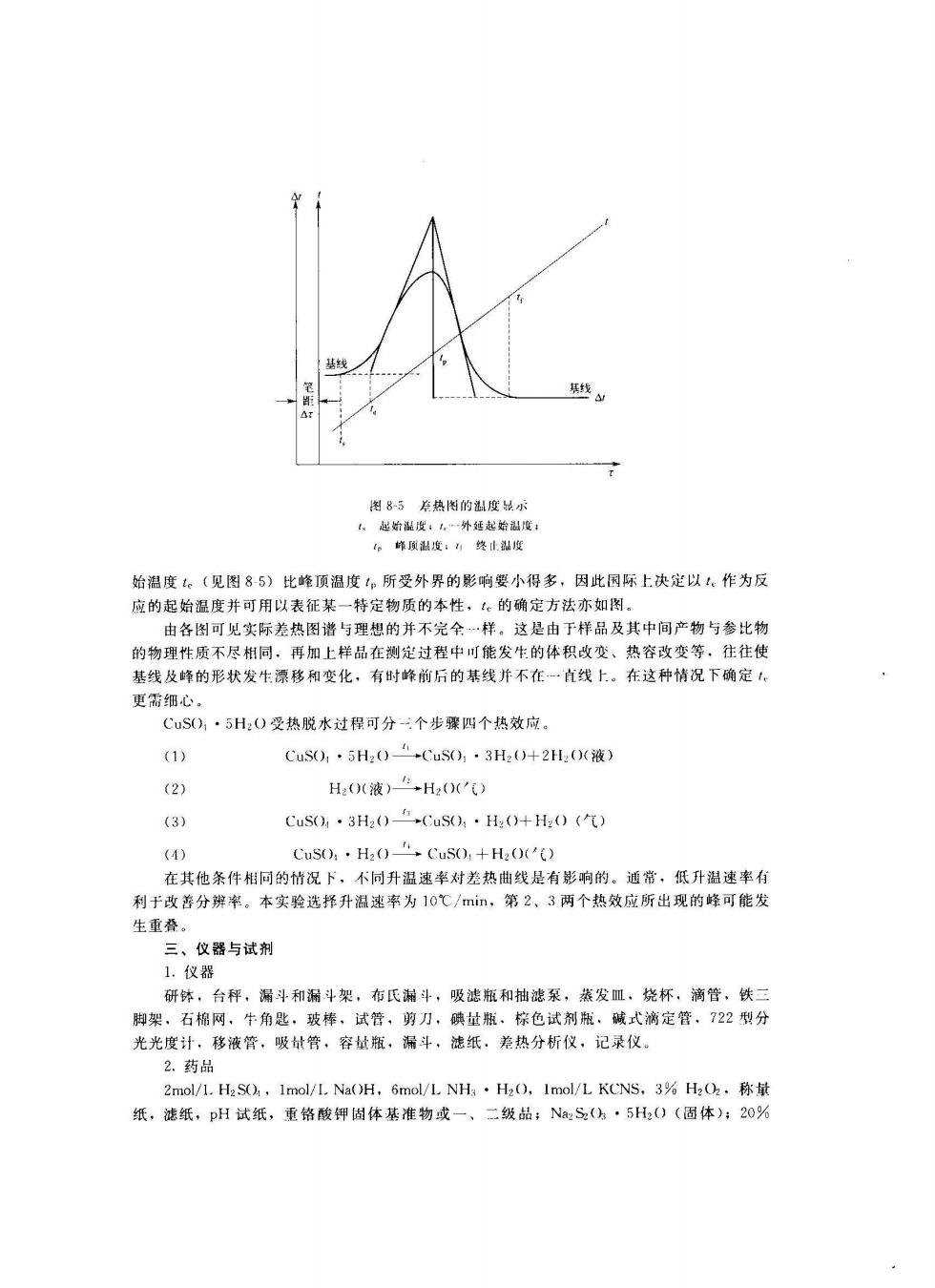
图8-5总热图的度单 七起始温度:,外延起始温度 。峰顶出度:婆止鼎度 始温度。(见图85)比峰顶温度。所受外界的影响要小得多,因此国际上决定以,作为反 由各图 完全…样。这是由于样品及其中间产物与参比物 的物理性质不尽相同、再加上样品在测定过程中可能发生的体积改变、热容改变等往往使 基线及峰的形状发牛漂移和变化,有时峰前后的基线并不在一直线上。在这种情况下确定 更需细心。 CuS(),·5H:()受热脱水过得可分-个步霹四个热效应 (1) CuS0,·5H204CuS),·3H0+2H:((液) (2) H(0(液)“,H2O') (3) Cus,·3H20,CuS),·H(O+Hz0(气) (11 CuS,·H20CuS0,+H20') 飞对他条件相的情况下,不问升温这事对差热猫线是有彬南的.道指·低升速事们 利于改善分辨率 率为10℃/min,第2、3两个热效应所出现的峰可能发 生重叠。 三、仪器与试剂 1.仪器 研体,台秤,漏斗和漏斗架,布氏湖斗,吸滤瓶和抽滤泵,蒸发皿,烧杯,滴管,铁三 脚架。石棉网,牛角匙,玻棒,试管、剪刀,碘址瓶、棕色试剂瓶,碱式滴定管,722型分 光光度计,移液管,吸管,容址瓶,漏斗,滤纸。差热分析仪,记录仪 2药品 2mol/1.HS,lmol/L.Na(H,6mol/LNH·Hz0,1nmol/L KCNS.3%HO,称量 纸,滤纸,pH试纸,重铬酸钾固体基准物或一、二级品:NS(方·5H0(固体):20%

K溶液,0.5%淀粉溶液:NC(方(固体),20%NH,HF2溶液,10%KCNS溶液,1:1 硝酸,20%KCNS,a-Al()h. 铁标准溶液: 称取0.8634gNH,Fc(S))2,置于烧杯中加1:1HN)420ml,加少许去离子水,将溶 液转移到1000l.容址瓶中,用去离子水稀释到刻度,每毫升此溶液含铁0.1mg 四、实验步骤 1。酸的 (1)称址和溶 将粗硫酸铜用研钵研细.用台科称取6g心研细的粗硫酸铜。放入已洗涤清洁的1O0ml 烧杯中。用量筒城取10m.去离子水,将水加人上述烧林中,然后把烧杯放在石棉树上小火 加热,并用玻棒搅拌,当硫酸制完全溶解时,立即仔止加热。 (2)沉淀 往溶液中加入几满稀HS(),酸化,再加入2ml.左右3%I(,溶液,微微加热,使其 允分反应。然后逐滴加人1mNa()H溶被,开龄时可以快加,快到H值答4时, 边加边检验pH值。 直到pH-1 可用常 减压两种方法之 进行过滤 ①常压过滤将折好的选纸放入漏斗中,用滴管滴加少量的去离子水润湿滤纸,使之 紧贴在漏斗壁上。将漏斗放在漏斗架上·将步骤(2)中调好pH值的硫酸铜溶液加热并趁 热过滤。滤液乐接在清洁的蒸发皿中,用滴管以少敏的上离子水淋洗烧杯和玻璃棒,洗涤水 也必须全部波入蒸发皿中。 ②减压过滤将布氏漏斗和抽滤瓶都用水洗净,并用去离广水淋洗2~3润,剪好涉纸 放入布氏温斗中,用少量大离子水润湿法纸,拍使滤纸紧结布氏强头,都执北蜜(2)中 调好H值的硫酸铜溶液趁热过逃,滤完后以少量水洗涤沉淀,将滤液移至发皿中备用 (3)蒸发和结晶 在滤液中加 2滴稀H2S):使溶液酸化、然后任石棉树上加热。蒸发、浓蜂(勿加热 过猛,以免液体飞溅损失)至溶液表而州出现薄层结品时,立即停止加热(注意不可蒸十! 为什么?):待蒸发皿冷却至室湿或稍冷却片刻后将蒸发皿放在盛有冷水的烧杯上冷却,使 CuS():5Hz()品体大址析出. (4)抽滤分离 将发皿内CuS),·5H品体和母液全部转移到布氏漏斗中,减压过滤,尽址抽T 并用下净的玻璃棒轻压布氏潮斗 内的 品体 除去品体间夹带的母 能 液。停止抽气 ,取出品体,把它在两张滤纸之间、轻压滤纸吸下产品,将产品包好,留待质量检 验用。 母液倒入公用台上CS),母液问收瓶。用台秤称量产品,计算产率。 2.澳址法测定铜的含址 (1》0.1mol/L.Na2S2()5标准溶液的祀制 称取10gNa2S01·5H0溶于400ml.新煮沸而冷却的去离千水中,待溶解后,加人 0.1gNC搅,存于棕色有塞瓶中,放置8~14天后标定其浓度 N2S(O标准溶液的标 准确称收已烘十的 重络酸钾固体六份分别于250mI.偏t瓶巾,用约20m[ 水溶解,加人20%KI溶液10ml.6mol/1.H2S()5ml,混匀后,盖好磨I1玻璃并向瓶寒