
C=Co(1一P),代入上式 =2Ck什l P关系式 (1-P2 Xn= 代入 X)2=2C8kH1 Xn~t关系式 表明(X)2与反应时间呈线性关系 聚合度随反应时间缓慢增加,要获得高分子量,需 要较长的时间 以(X)对t作图,直线的斜率可求得速率常数k 2024/10/7 21
2024/10/7 21 表明 (Xn)2与反应时间 t呈线性关系 聚合度随反应时间缓慢增加,要获得高分子量,需 要较长的时间 以(Xn)2对 t 作图,直线的斜率可求得速率常数 k C = Co (1-P),代入上式 2C k t 1 (1 P ) 1 2 0 2 + - = P~t关系式 1 P 1 Xn - = 代入 X ) 2C kt 1 2 0 2 ( n = + Xn ~t关系式 讨 论

外加酸催化缩聚反应 为了加速反应,常外加酸作为聚酯化反应的催化剂 反应速率将由自催化和酸催化两项组成: dC kC3 +ka[H*1C dt dC =(kC+kaH*1)C2 dt 作为催化剂,H不变,且kaH]>kC,kC略去 并令k=kaH],则 dC =kC2 此时外加酸催化为二级反应 dt 2024/10/7 22
2024/10/7 22 为了加速反应,常外加酸作为聚酯化反应的催化剂 反应速率将由自催化和酸催化两项组成: 作为催化剂,[H+ ]不变,且 ka [H+ ] >> kC,kC略去 并令k`= ka [H+ ],则 外加酸催化缩聚反应 2 a 3 k C k [ H ]C dt dC + - = + 2 ( k C ka[ H ] )C dt dC + - = + 2 k`C dt dC - = 此时外加酸催化为二级反应

积分得 11 =k't C Co 将C=Co(1一P)代入上式 =kCot+1 P~关系式 HP Xn=k Cot+1 Xn~t关系式 X与反应时间t呈线性关系,由斜率可求得k 论 外加酸聚酯化的k比自催化k大将近两个数量级 工业生产总是以外加酸作催化剂来加速反应 2024/10/7 23
2024/10/7 23 Xn与反应时间 t 呈线性关系,由斜率可求得k` 外加酸聚酯化的 k` 比自催化 k 大将近两个数量级 工业生产总是以外加酸作催化剂来加速反应 积分得 k`t C 1 C 1 0 - = 将 C = Co (1-P) 代入上式 k`C t 1 1 P 1 = 0 + - Xn = k`C0 t+1 P~t关系式 Xn~t关系式 讨 论
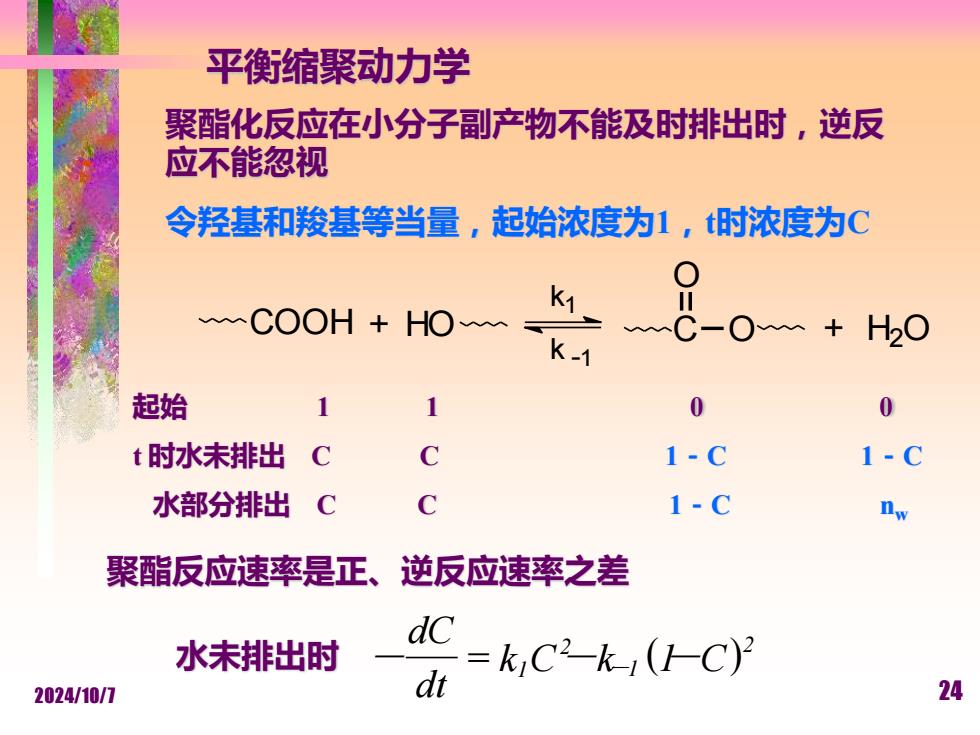
平衡缩聚动力学 聚酯化反应在小分子副产物不能及时排出时,逆反 应不能忽视 令羟基和羧基等当量,起始浓度为1,t时浓度为C COOH HO k1C-0+20 k-1 起始 1 1 0 0 t时水未排出 C C 1-C 水部分排出 C C 1-C nw 聚酯反应速率是正、 逆反应速率之差 水未排出时 =kC2-k-(HC) 2024/10/7 dt 24
2024/10/7 24 平衡缩聚动力学 聚酯反应速率是正、逆反应速率之差 聚酯化反应在小分子副产物不能及时排出时,逆反 应不能忽视 令羟基和羧基等当量,起始浓度为1,t时浓度为C COOH HO k1 k -1 + C O O + H2 O 起始 1 1 0 0 t 时水未排出 C C 1-C 1-C 水部分排出 C C 1-C nw ( ) 2 1 2 k1 C k 1 C dt dC 水未排出时 - = - - -

水部分排出时 dt =k C2kj (HC)nm 根据反应程度关系式 No-N P CrC=FC .C=-P No Co 引入平衡常数:K=k1/k.1,k.1=k1/K,代入上两式 整理: 水未排出时: =k(-PY-P/K] dt 水部分排出时: dt =kl(H-PY-Pnv/K] 总反应速率与反应程度、平衡常数、, 低分子副产物含量有关 2024/10/7 25
2024/10/7 25 水部分排出时 引入平衡常数: K= k1 / k-1 ,k-1 = k1 / K , 代入上两式 1 ( ) W 2 1 k C k 1 C n dt dC - = - - - 根据反应程度关系式 k [(1 P) P K] dt dP 2 2 = 1 - - 1 1 C C C C N N N P 0 0 0 0- - - = = = ∴C =1-P 整理: k [(1 P) P n K] dt dP w 2 = 1 - - 水未排出时: 水部分排出时: 总反应速率与反应程度、平衡常数、低分子副产物含量有关