
S型结合曲线表明蛋白质结合氧的行为特殊。一个位点结合氧分子将增加该蛋白其它空 余位点结合氧的能力。相反,一个位点排出氧分子将增加该蛋白质其它位,点排出氧分子的能 力。这种结合行为叫协同性,因为一个位点的结合反应与该蛋白质其它位点结合性相互依赖。 下面我们将详细讨论协同结合的机理。 血红蛋白结合氧的协同性有什么生理意义?氧必须在血液中从肺部(相对压强是100 tor)运输到代谢活跃的组织(氧分压很低,典型的数据是20tor)。S型曲线的协同行为能 够有效地运输氧(图7.8)。在肺部,氧结合血红蛋白达到98%的饱和度。进入组织血红蛋 白结合氧的饱和度就跌至32%,即释放了66%的氧气(98%-32%=66%)。协同性释放有 助于血液在组织更完全地释放氧气。如果采用肌红蛋白运输氧气,在肺部98%的氧结合位 点结合氧,但是在组织还有91%的位点处于氧结合状态,即只有7%的结合位点运输氧气。 因此肌红蛋白结合氧的能力太强而不适于承担运氧功能。如果蛋白没有协同性(但生物进化 是蛋白结合氧能力达到最佳状态),从100tor的氧分压环境到达20tor的氧分压环境,有 38%的氧结合位,点运送氧(63%-25%=38%)。因此血红蛋白的协同性结合和释放氧气使血 红蛋白运氧能力相当于肌红蛋白和非协同性氧结合蛋白运氧能力的10倍和17倍。 Tissues Lungs Myoglobin 1.0 7% Hemoglobin 0.8 66% No 0.6 cooperativity 38% (hypothetical) 0.4 0.2 0.0 02050 100 150 200 pO2(torr) 28topn 国7.8协同性促进血红蛋白的运氧能力。由于血红蛋白氧结合位点具有协同性,血红蛋白 运氧能力比肌红蛋白和非协同性蛋白(即使这种蛋白具有最佳的氧亲和性)运氧能力更大。 进一步考察休息状态和运动状态组织的氧浓度揭示血红蛋白运氧的效率(图7.9)。在休 息状态,肌肉的氧浓度达到40tor。在运动状态肌肉的氧浓度只有20tor。从肺部氧分压 100tor到休息肌肉的40tor,血红蛋白氧结合位点从98%结合降低至77%结合,释放了21% 的氧气(而氧分压降低了60torr)。从40torr的氧分压降低至20tor,氧结合的饱和度从77% 降低至32%,释放了45%的结合氧(虽然氧分压只降低20or)。因此从静止到运动氧浓度 的变化相应于氧结合曲线最陡峭的区域,因此能够在组织最需要的时候有效地供应氧。73 节我们还要介绍血红蛋白促进生理应答的其它特性
S 型结合曲线表明蛋白质结合氧的行为特殊。一个位点结合氧分子将增加该蛋白其它空 余位点结合氧的能力。相反,一个位点排出氧分子将增加该蛋白质其它位点排出氧分子的能 力。这种结合行为叫协同性,因为一个位点的结合反应与该蛋白质其它位点结合性相互依赖。 下面我们将详细讨论协同结合的机理。 血红蛋白结合氧的协同性有什么生理意义?氧必须在血液中从肺部(相对压强是 100 torr)运输到代谢活跃的组织(氧分压很低,典型的数据是 20 torr)。S 型曲线的协同行为能 够有效地运输氧(图 7.8)。在肺部,氧结合血红蛋白达到 98%的饱和度。进入组织血红蛋 白结合氧的饱和度就跌至 32%,即释放了 66%的氧气(98% - 32% = 66%)。协同性释放有 助于血液在组织更完全地释放氧气。如果采用肌红蛋白运输氧气,在肺部 98%的氧结合位 点结合氧,但是在组织还有 91%的位点处于氧结合状态,即只有 7%的结合位点运输氧气。 因此肌红蛋白结合氧的能力太强而不适于承担运氧功能。如果蛋白没有协同性(但生物进化 是蛋白结合氧能力达到最佳状态),从 100 torr 的氧分压环境到达 20 torr 的氧分压环境,有 38%的氧结合位点运送氧(63% - 25% = 38%)。因此血红蛋白的协同性结合和释放氧气使血 红蛋白运氧能力相当于肌红蛋白和非协同性氧结合蛋白运氧能力的 10 倍和 1.7 倍。 图 7.8 协同性促进血红蛋白的运氧能力。由于血红蛋白氧结合位点具有协同性,血红蛋白 运氧能力比肌红蛋白和非协同性蛋白(即使这种蛋白具有最佳的氧亲和性)运氧能力更大。 进一步考察休息状态和运动状态组织的氧浓度揭示血红蛋白运氧的效率(图 7.9)。在休 息状态,肌肉的氧浓度达到 40 torr。在运动状态肌肉的氧浓度只有 20 torr。从肺部氧分压 100 torr 到休息肌肉的 40 torr,血红蛋白氧结合位点从 98%结合降低至 77%结合,释放了 21% 的氧气(而氧分压降低了 60 torr)。从 40 torr 的氧分压降低至 20 torr,氧结合的饱和度从 77% 降低至 32%,释放了 45%的结合氧(虽然氧分压只降低 20 torr)。因此从静止到运动氧浓度 的变化相应于氧结合曲线最陡峭的区域,因此能够在组织最需要的时候有效地供应氧。7.3 节我们还要介绍血红蛋白促进生理应答的其它特性
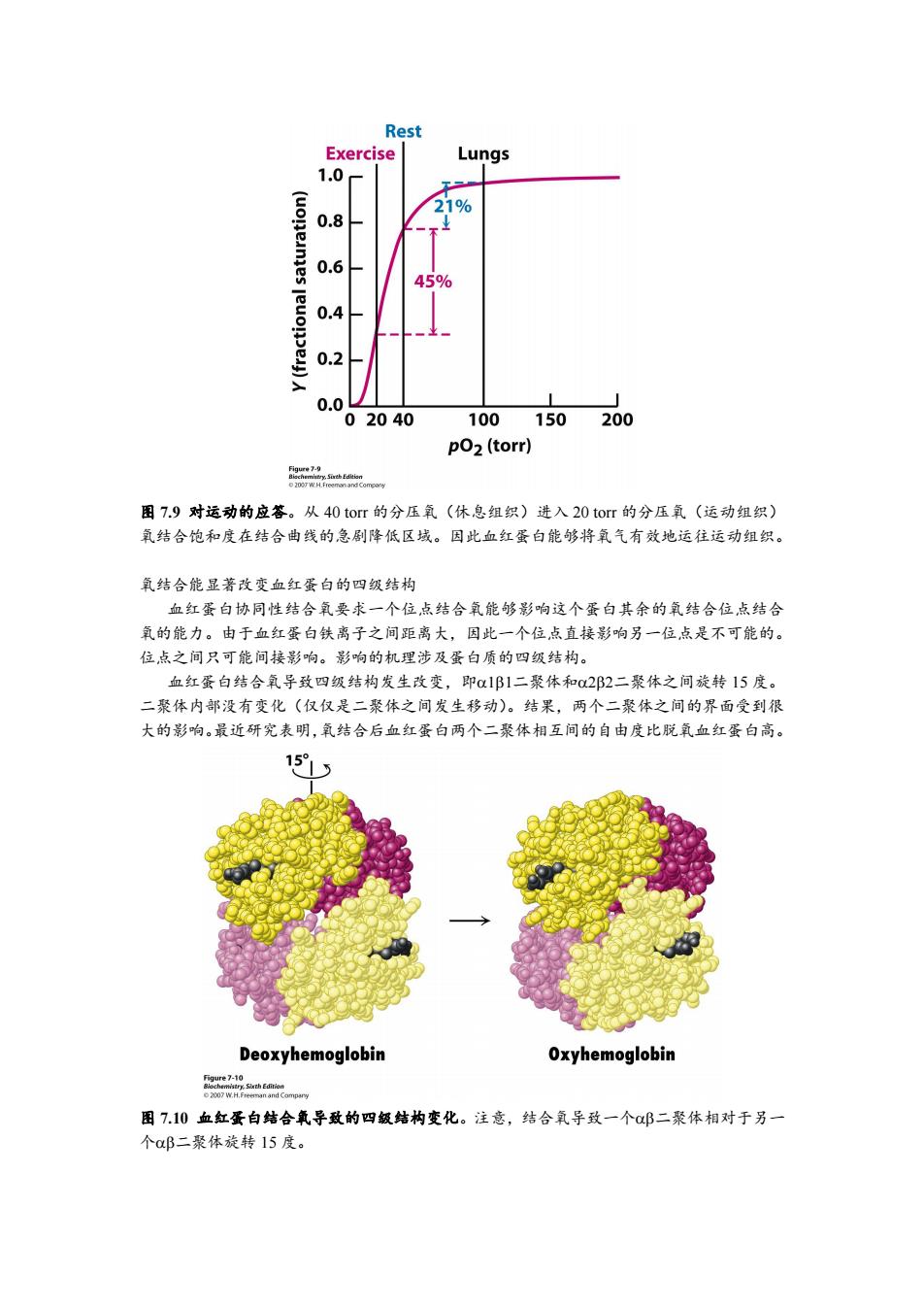
Rest Exercise Lungs 1.0 21% 0.8 0.6 45% 0.4 0.2 0.0 02040 100 150200 pO2(torr) i 图7.9对运动的应答。从40tor的分压氧(休息组织)进入20tor的分压氧(运动组织) 氧结合饱和度在结合曲线的急剧降低区域。因此血红蛋白能够将氧气有效地运往运动组织。 氧结合能显著改变血红蛋白的四级结构 血红蛋白协同性结合氧要求一个位,点结合氧能够影响这个蛋白其余的氧结合位点结合 氧的能力。由于血红蛋白铁离子之间距离大,因此一个位,点直接影响另一位点是不可能的。 位点之间只可能间接影响。影响的机理涉及蛋白质的四级结构。 血红蛋白结合氧导致四级结构发生改变,即α1B1二聚体和o2β2二聚体之间旋转15度。 二聚体内部没有变化(仅仅是二聚体之间发生移动)。结果,两个二聚体之间的界面受到很 大的影响。最近研究表明,氧结合后血红蛋白两个二聚体相互间的自由度比脱氧血红蛋白高。 151 Deoxyhemoglobin Oxyhemoglobin 的eei识Sirth oion o 2007 W.H.Freemman and Comparw 图7.10血红蛋白结合氧导致的四级结构变化。注意,结合氧导致一个邱二聚体相对于另一 个aB二聚体旋转15度
图 7.9 对运动的应答。从 40 torr 的分压氧(休息组织)进入 20 torr 的分压氧(运动组织) 氧结合饱和度在结合曲线的急剧降低区域。因此血红蛋白能够将氧气有效地运往运动组织。 氧结合能显著改变血红蛋白的四级结构 血红蛋白协同性结合氧要求一个位点结合氧能够影响这个蛋白其余的氧结合位点结合 氧的能力。由于血红蛋白铁离子之间距离大,因此一个位点直接影响另一位点是不可能的。 位点之间只可能间接影响。影响的机理涉及蛋白质的四级结构。 血红蛋白结合氧导致四级结构发生改变,即二聚体和二聚体之间旋转 15 度。 二聚体内部没有变化(仅仅是二聚体之间发生移动)。结果,两个二聚体之间的界面受到很 大的影响。最近研究表明,氧结合后血红蛋白两个二聚体相互间的自由度比脱氧血红蛋白高。 图 7.10 血红蛋白结合氧导致的四级结构变化。注意,结合氧导致一个二聚体相对于另一 个二聚体旋转 15 度

脱氧血红蛋白的四级结构称为T(即紧缩,tens肥)型(因为亚基之间的限制大)。所有 位点都结合氧的四级结构称为R型(即松弛,rlax)。根据R约束少的观察,紧缩(T)和 松弛(R)的称谓似乎特别贴切。重要的地方在于,R状态限制少,与氧气的结合力大:而T 状态受限多,与氧结合力弱。氧与血红蛋白一个结合位点结合启动整个蛋白分子从T型转 化成R-型,增加了其余位点结合氧的亲和性。 血红蛋白的亲和性可以用几个模型解释 为了解释配体与多亚基蛋白质之间的结合特性,建立了两个限制模型。协同模型,即 MWC模型,是Jacques Monod,Jeffries Wyman,.和Jean-Pierre Changeux首先提出来的。该 模型假定多亚基蛋白质有两个结构状态,即T态和R态。配体与多亚基蛋白的结合使两种 结构状态发生移动(图7.11)。因此血红蛋白每与一个氧气分子结合,就导致四聚体向R态 转变的可能性就增加。在脱氧状态,血红蛋白四聚体几乎全都是T态。但是,氧分子与一 个结合位点结合就会导致蛋白质从T态向R态转变,因此蛋白质结合氧的亲和力大大提高。 氧气更容易与其它三个空余的结合位点结合。氧气浓度低,所有蛋白质分子处于T态,与 氧的结合曲线就很低。有一部分位点结合氧气,导致蛋白质分子变成R态,氧结合曲线就 非常陡峭。随后,R态蛋白质所有位点都结合氧分子不能在结合氧分子,氧结合曲线回复成 平坦(图7.12)。这些事件导致血红蛋白结合氧呈“S”型曲线,蛋白质结合氧的这种特性 使之能够有效地运输氧气。 T state KT 01 01 02 02 02 02 02 02 02 02 Tstate R state strongly J strongly favored favored 02 01 R state Figure 7-11 Biochemistry,Sixth Edition 2007 W.H.Freeman and Compary 国711协同模型。所有分子要么呈T态,要么是R态。在各种氧结合水平都存在T结构和 R结构之间的平衡。蛋白质没有结合氧,平衡倾向于T结构。当所有位点都与氧结合,平衡 倾向于R结构。R态结合位,点对氧的亲和性远远大于T态
脱氧血红蛋白的四级结构称为 T(即紧缩,tense)型(因为亚基之间的限制大)。所有 位点都结合氧的四级结构称为 R 型(即松弛,relax)。根据 R 约束少的观察,紧缩(T)和 松弛(R)的称谓似乎特别贴切。重要的地方在于,R 状态限制少,与氧气的结合力大;而 T 状态受限多,与氧结合力弱。氧与血红蛋白一个结合位点结合启动整个蛋白分子从 T-型转 化成 R-型,增加了其余位点结合氧的亲和性。 血红蛋白的亲和性可以用几个模型解释 为了解释配体与多亚基蛋白质之间的结合特性,建立了两个限制模型。协同模型,即 MWC 模型,是 Jacques Monod, Jeffries Wyman, 和 Jean-Pierre Changeux 首先提出来的。该 模型假定多亚基蛋白质有两个结构状态,即 T 态和 R 态。配体与多亚基蛋白的结合使两种 结构状态发生移动(图 7.11)。因此血红蛋白每与一个氧气分子结合,就导致四聚体向 R 态 转变的可能性就增加。在脱氧状态,血红蛋白四聚体几乎全都是 T 态。但是,氧分子与一 个结合位点结合就会导致蛋白质从 T 态向 R 态转变,因此蛋白质结合氧的亲和力大大提高。 氧气更容易与其它三个空余的结合位点结合。氧气浓度低,所有蛋白质分子处于 T 态,与 氧的结合曲线就很低。有一部分位点结合氧气,导致蛋白质分子变成 R 态,氧结合曲线就 非常陡峭。随后,R 态蛋白质所有位点都结合氧分子不能在结合氧分子,氧结合曲线回复成 平坦(图 7.12)。这些事件导致血红蛋白结合氧呈“S”型曲线,蛋白质结合氧的这种特性 使之能够有效地运输氧气。 图 7.11 协同模型。所有分子要么呈 T 态,要么是 R 态。在各种氧结合水平都存在 T 结构和 R 结构之间的平衡。蛋白质没有结合氧,平衡倾向于 T 结构。当所有位点都与氧结合,平衡 倾向于 R 结构。R 态结合位点对氧的亲和性远远大于 T 态