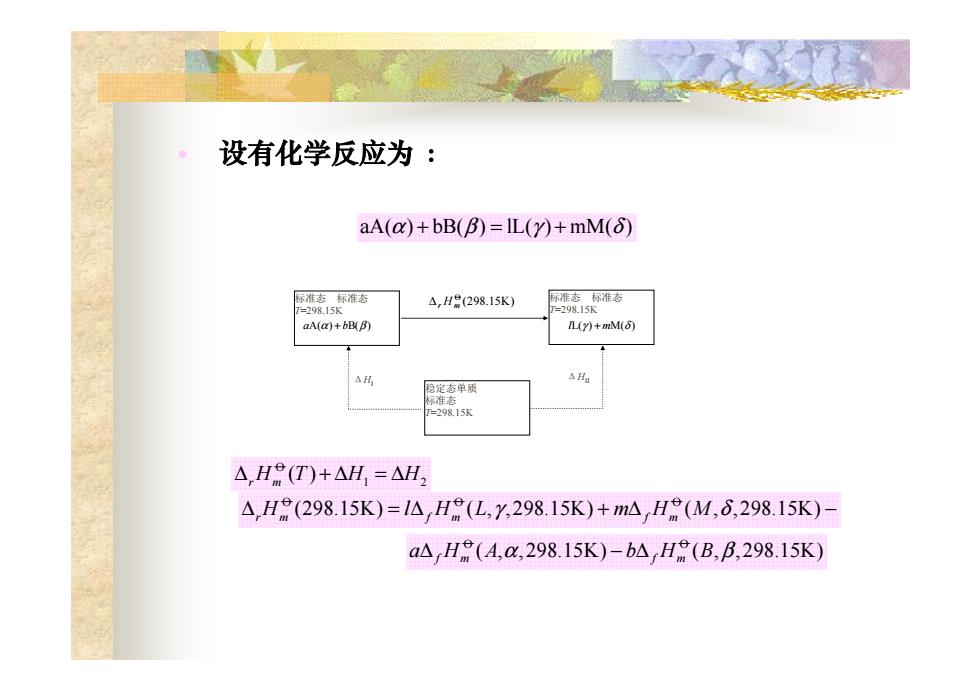
。 设有化学反应为: aA(a)+bB(B)=IL()+mM(6) 际准态标谁态 △,H8(298.15K) 际准态标准态 =298.15K =298.15K aA(a)+bB(B) L()+mM(6) △H 隐定态单质 标准态 7=298.15K △HR(T)+△H,=△H2 △,H(298.15K)-1△H(L,Y,298.15K)+mAH(M,6,298.15K)- aAH(A,a,298.15K)-b△H(B,B,298.15K)
标准态 标准态 T=298.15K 标准态 标准态 T=298.15K 稳定态单质 标准态 T=298.15K ΔHI ΔHII • 设有化学反应为 : aA( ) bB( ) lL( ) mM( ) α + =+ β γ δ (298.15K) O ∆r Hm aA(α) + bB(β) lL(γ ) + mM(δ ) O 1 2 ( ) ∆ +∆ =∆ r m H THH OO O (298.15K) ( , ,298.15K) ( , ,298.15K) ∆ =∆ + ∆ − rm f m f m H lHL mHM γ δ O O ( , ,298.15K) ( , ,298.15K) fm fm aH A bHB ∆ −∆ α β

。对于一般的化学反应 0=∑yB B △,H9(T)=∑y△H9(B) B
• 对于一般的化学反应 • 0 BB B = ∑v O O () () r m Bf m B ∆ =∆ H T v HB ∑

4、标准摩尔燃烧焓 定义:1mo物质在反应温度T、标准状态下"完全氧 化”,即"完全燃烧"的摩尔反应焓变称为该物质的标 准摩尔燃烧焓(standard molar enthalpy of combustion)或标准摩尔燃烧焓(standard molar heat of combustion),用符号△.H,(B) 表示。 所谓完全燃烧"是在燃烧反应中C被氧化为CO2 (g),H被氧化为H2O(I),S被氧化为SO2 (g),N变为N2(g)。 对于一般的化学反应 0=∑vBB A,H8(T)=-∑'A,H(B)
• 4、标准摩尔燃烧焓 • 定义:1mol物质在反应温度T、标准状态下“完全氧 化”,即“完全燃烧”的摩尔反应焓变称为该物质的标 准摩尔燃烧焓(standard molar enthalpy of combustion)或标准摩尔燃烧焓(standard molar heat of combustion),用符号 表示。 • 所谓“完全燃烧”是在燃烧反应中C被氧化为CO2 (g),H被氧化为H2O(l),S被氧化为SO2 (g),N变为N2(g).。 • 对于一般的化学反应 O ( ) ∆c m H B 0 BB B = ∑v O O () () r m Bc m B ∆ =− ∆ H T v HB ∑

§3一2化学反应的熵变 1、热力学第三定律 普朗克:“在绝对零度时任何完美晶体的熵等 于零。” 所谓完美晶体”即在晶体中,分子或原子只 有一种排列方式. 例如,若NO在晶体中有 NONONONO."和 NOONNONOON."两种排列方式,这 就不是完美晶体
§3—2 化学反应的熵变 • 1、热力学第三定律 • 普朗克 : “在绝对零度时任何完美晶体的熵等 于零。” • 所谓“完美晶体”即在晶体中,分子或原子只 有一种排列方式. • 例如,若NO在晶体中有 “NONONONO.”和 “NOONNONOON.”两种排列方式,这 就不是完美晶体

2、物质的规定熵和标准熵 物质的规定熵:由热力学第三定律的规定为基础,求 得的1mol纯物质在温度为T时的嫡值称为物质在此 条件下的规定嫡(conventional entropy),用 符号Sm(B,T)表示。 若从OK到T的过程中物质无相变化,则 物质的标准熵:若物质是处于T时的标准状态() 下,其规定熵用用特S$(T) 表示,称为该物质在 T时的标准摩尔嫡(standard molar entropy)
• 2、物质的规定熵和标准熵 • 物质的规定熵:由热力学第三定律的规定为基础,求 得的1mol纯物质在温度为T时的熵值称为物质在此 条件下的规定熵(conventional entropy),用 符号Sm(B,T)表示。 • 若从0K到T的过程中物质无相变化,则 • 物质的标准熵:若物质是处于T时的标准状态(pθ) 下,其规定熵用用符号 表示,称为该物质在 T时的标准摩尔熵(standard molar entropy)。 O ( ) m S T C T T T S B T C p m T p m T m dln d ( , ) , ln0 , ∫0 ∫ = =