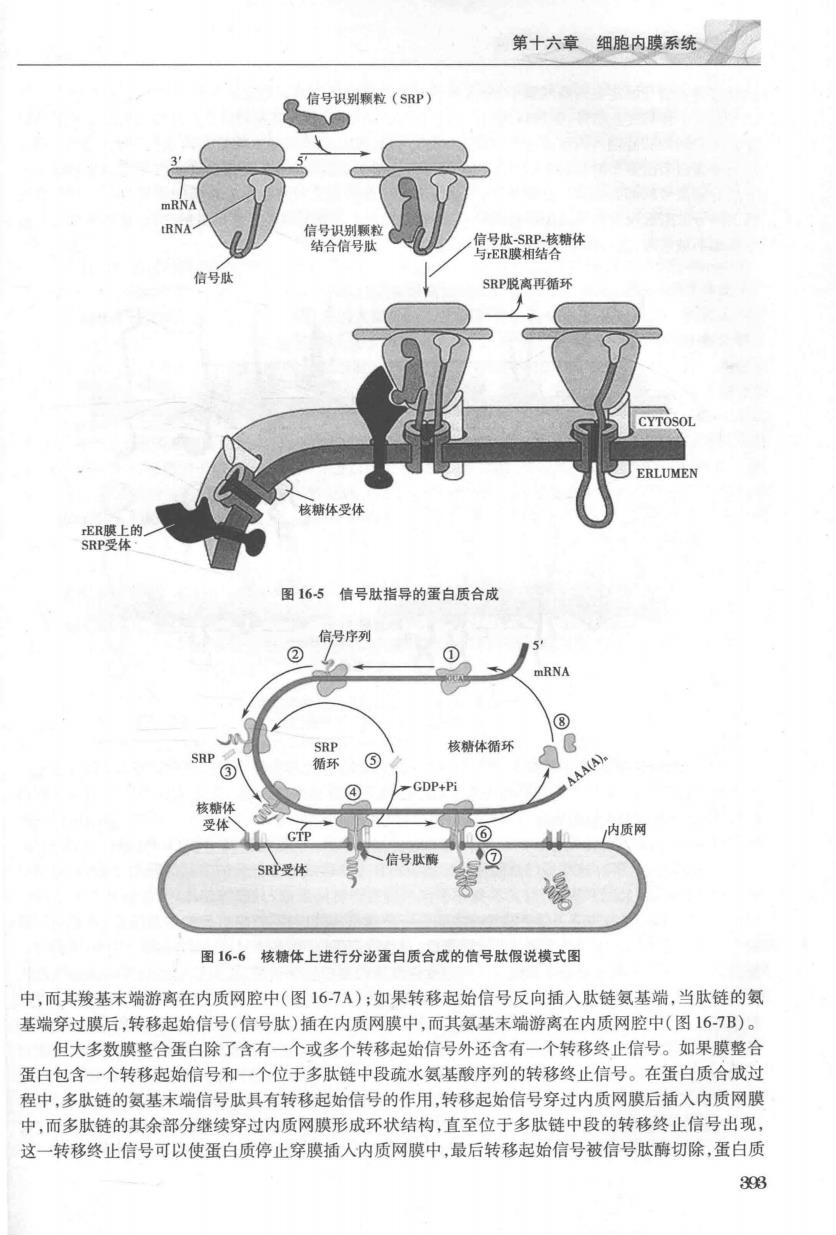
第十六章细胞内膜系统 信号识别颗粒(SP】 停2落糖体 SRP脱离再循环 图165信号肽指导的蛋白质合成 信号序列 核糖体循环 GDP+P 质两 信号肽酶 SRP受 图166核糖体上进行分泌蛋白质合成的信号肽假说模式图 中,而其羧基末端游离在内质网腔中(图167A):如果转移起始信号反向插入肽链氨基端,当肽链的氨 基端穿过膜后,转移起始信号(信号肽)插在内质网膜中,而其氨基末端游离在内质网腔中(图16-7B)。 但大多数膜整合蛋白除了含有一个或多个转移起始信号外还含有一个转移终止信号。如果膜整合 蛋白包含一个转移起始信号和一个位于多肽链中段硫水氨基酸序列的转移终止信号。在蛋白质合成过 程中,多肽链的氨基末端信号肽具有转移起始信号的作用,转移起始信号穿过内质网膜后插入内质网膜 中,而多肽链的其余部分继续穿过内质网膜形成环状结构,直至位于多肽链中段的转移终止信号出现, 这一转移终止信号可以使蛋白质停止穿膜插人内质网膜中,最后转移起始信号被信号肽酶切除,蛋白质 393
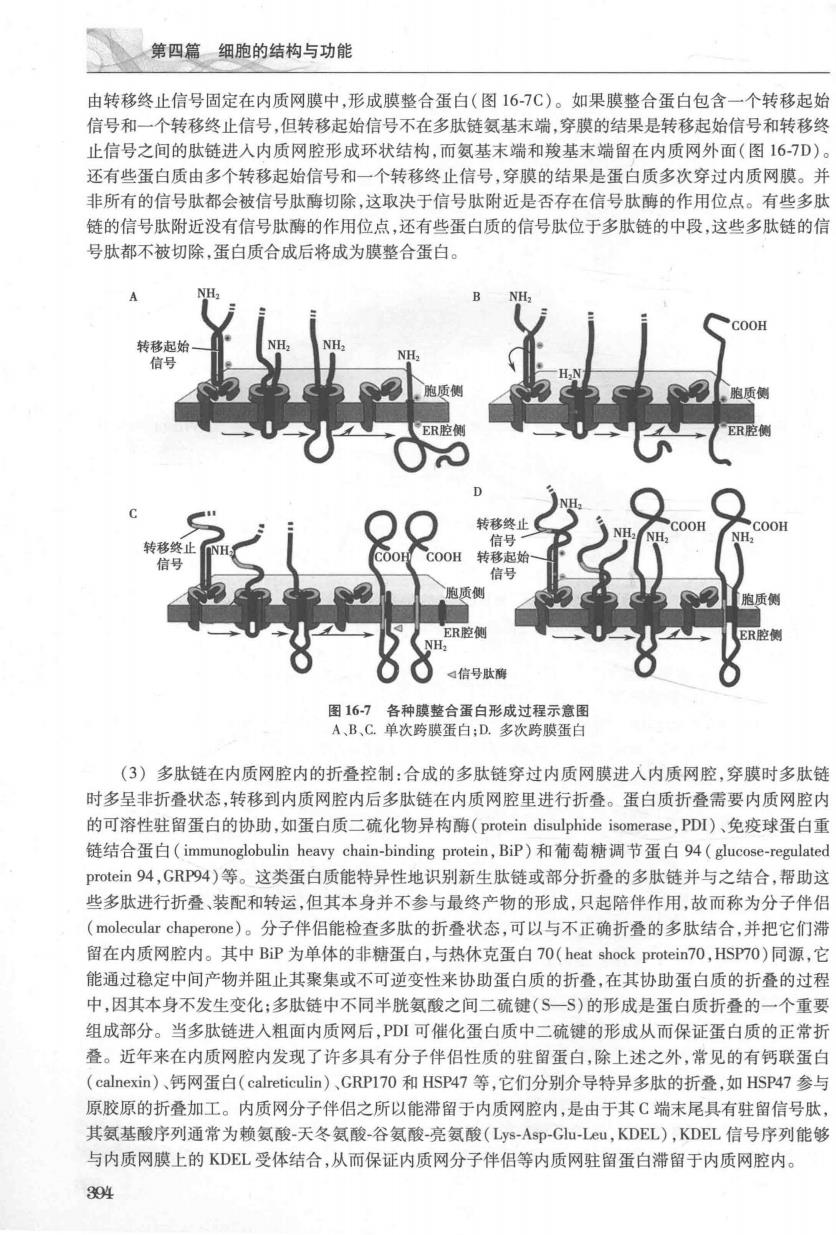
第四篇细胞的结构与功能 由转移终止信号固定在内质网膜中,形成膜整合蛋白(图16-7C)。如果膜整合蛋白包含一个转移起始 信号和一个转移终止信号,但转移起始信号不在多肽链氨基末端,穿膜的结果是转移起始信号和转移终 止信号之间的肽链进入内质网腔形成环状结构,而氨基末端和羧基末端留在内质网外面(图167D》 还有些蛋白质由多个转移起始信号和一个转移终止信号,穿膜的结果是蛋白质多次穿过内质网膜。并 非所有的信号肽都会被信号肽德切除这取决干信县肽附折是否存在信号肚酶的作用位占。有此多肽 链的信号肽附近没有信号肽酶的作用位点,还有些蛋白质的信号肽位于多肽链的中段,这些多肽链的信 号肽都不被切除,蛋白质合成后将成为膜整合蛋白。 ER腔 图16-]各种膜整合蛋白形成过程示意图 A、B,C单次跨膜蛋白:D.多次跨膜蛋白 (3)多肽链在内质网腔内的折叠控制:合成的多肽链穿过内质网膜进人内质网腔,穿膜时多肽链 时多呈非折叠状态,转移到内质网腔内后多肽链在内质网腔里进行折叠。蛋白质折叠需要内质网腔内 的可溶性驻留蛋白的协助,如蛋白质二硫化物异构酶(protein disulphide isomerase,PDI)、免疫球蛋白重 链结合蛋白(immunoglobulin heavy chain-binding protein,BP)和葡萄糖调节蛋白94(glucose-regulatec prot©in94,GRP94)等。这类蛋白质能特异性地识别新生肽链或部分折叠的多肽链并与之结合,帮助这 些多肽进行折叠、装配和转运,但其本身并不参与最终产物的形成,只起陪伴作用,故而称为分子伴侣 (molecular chaperone)。分子伴侣能检查多肽的折叠状态,可以与不正确折叠的多肽结合,并把它们 留在内质网腔内。其中BP为单体的非糖蛋白,与热休克蛋白70(heat shock protein70,HSPT0)同源,它 能通过稳定中间产物并阻止其聚集或不可逆变性来协助蛋白质的折叠,在其协助蛋白质的折叠的过稻 中,因其本身不发生变化:多肽链中不同半胱氨酸之间二硫键(S一S)的形成是蛋白质折叠的一个重要 组成部分。当多肽链进入粗面内质网后,PD可催化蛋白质中二硫键的形成从而保证蛋白质的正常折 叠。近年来在内质网腔内发现了许多具有分子伴侣性质的驻留蛋白,除上述之外,常见的有钙联蛋白 (calnexin)、钙网蛋白(calreticulin)、GRPI70和HsP47等,它们分别介导特异多肽的折叠,如HSP47参与 原胶原的折叠加工。内质网分子伴侣之所以能滞留于内质网腔内,是由于其C端末尾具有驻留信号肽, 其氨基酸序列通常为赖氨酸-天冬氨酸-谷氨酸-亮氨酸(Lys-Asp-G-Lu,KDEL),KDEL信号序列能够 与内质网膜上的KDEL受体结合,从而保证内质网分子伴侣等内质网驻留蛋白滞留于内质网腔内。 394

第十六章细胞内膜系统、 从内质网输送到高尔基复合体的蛋白质必须是正确折叠和组装的。错误折叠和未完全组装的蛋白 质则被保留在内质网之内,并通过内质网膜上的Sc61转位子从内质网内腔输送到细胞质,再被降解 因此,在蛋白质合成过程中,内质网还起到一个质量控制器的作用。这种质量控制过程主要由内质网腔 内的分子伴侣蛋白来完成。内质网腔内的分子伴侣蛋白可以特异性地识别错误折叠和未完全组装的蛋 白,并把它们滞留在内质网中,同时内质网腔内非折叠蛋白的积聚,可以引起内质网的未折叠蛋白反应 (unfolded protein response,UPR),使内质网腔内的分子伴侣蛋白表达升高,从而有利于蛋白质的正确折 叠和组装。 2.粗面内质网与蛋白质的糖基化修饰粗面内质网的另一个功能是蛋白质糖基化(lycosylation) 糖基化是指在酶的控制下,蛋白质或脂质附加上糖类的修饰过程。在胞质中游离多聚核糖体合成的可 溶性蛋白质都未被糖基化,而在内质网合成的大部分蛋白质都需要糖基化后形成船蛋白。例如由内质 网合成并输送到高尔基体、容酶体、细胞膜以及细胞外的蛋白质大多数是糖蛋白。研究表明,催化糖基 的酶在粗面内质网上,这些糖蛋白的糖基化过程从内质网开始,并最后在高尔基复合体中完成。现已知 最多见的部位是寡多糖以共价键形式与多肽链上天冬酰胺(Asn)残基的-NH2基团相连接,称N-结合型 寡多糖。N结合型寡多糖的糖基化(简称N-连接糖基化)过程在粗面内质网完成,连接的寡糖由N-乙 酰葡萄糖胺、甘露糖和葡萄糖组成:另一类发生于高尔基复合体中的糖基化称为0结合型寡多糖(简称 O-连接糖基化),寡糖分子以共价键形式与蛋白质上丝氨酸、苏氨酸、酪氨酸残基侧链的0H基团结合 形成0-连接寡糖糖蛋白,连接的糖为半乳糖或八-乙酰半乳糖胺。完成糖基化修饰的糖蛋白由多肽链和 结合在多肽链上的寡多糖侧链组成,若在蛋白质的许多部位都发生糖基化作用,无疑会干扰蛋白质 在粗面内质网膜上有一种带有高能键的特殊脂质分子多話醇(dolichol),它通过焦磷酸键与寡多糖 相连成为供体,然后把整个寡多糖链转移到多肽链上。寡多糖从多萜醇供体转移到多肽链的天冬酰胺 残基上是在内质网腔面进行的,催化这一过程的糖基转移酶是一种活性部位暴露在内质网腔侧面的膜 结合蛋白质。在蛋白质合成过程中,当内质网腔内多肽链上的天冬酰胺残基露出时,这种酶就将寡多糖 从多萜醇转移到天冬酰胺残基上 在相面内质网上进行的糖基化大多为N连接糖基化,由多萜醇提供的寡多糖含有2个分子N-乙酰 葡糖胺、9个分子甘露糖和3个分子葡萄糖,构成了寡多糖的核心区(core region)和末端区(terminal re g)。该结构与成熟糖蛋白中的寡多糖结构有较大的差别,因此需要修饰和改建。在粗面内质网中, 糖蛋白N糖基化寡糖链上的3个葡萄糖和1个甘露糖分子被切除,实现初步的糖基化修饰,进一步的修 饰和改建则在高尔基体中进行 3.粗面内质网与蛋白质运输研究蛋白质在细胞内的运输途径,电镜放射自显影是较早应用的方 法。早在20世纪60年代,就有人用这一技术研究胰腺细脑的蛋白质分泌活动。胰腺细胞的功能比较 单纯,主要合成供分泌的蛋白质,有利于用放射自显影方法示踪蛋白质在细胞内的合成和运输途径。实 验结果表明,用[H]标记亮氨酸,5分钟后可在粗面内质网探测到放射自显影银粒,再过数分钟后可在 高尔基复合体中见到,37分钟后便进人浓缩泡之中。说明胰腺细胞摄取氨基酸后在内质网参人新合成 的蛋白质然后经高尔基体、分泌颗粒而分泌到细胞外。后来发现,在各种类型的分泌蛋白质细胞中,由 核糖体合成的分泌蛋白质进入内质网腔之后,经过折叠和糖基化作用之后并不能直接分泌,必须经内质 网和高尔基体,到分泌颗粒这一途径。这是分泌蛋白的常见胞吐途径。另一种途径是含有分泌蛋白质 的小泡由内质网脱落后直接形成浓缩泡,再由浓缩泡变为分泌颗粒而出胞。 (二)滑面内质网的功能 虽然在绝大多数细胞中,滑面内质网的形态相似,但其化学组成、酶的种类和含量以及大分子结构 等均存在差异。因此,滑面内质网的功能比较复杂,即使在同一种细胞,滑面内质网也可能有多种功能 1.滑面内质网与脂类、类固醇激素的合成滑面内质网中含有膜脂合成以及胆固醇合成、激素转 化的全套酶系,是细胞内脂类合成的主要场所。脂质分子如磷脂和胆固醇等是由滑面内质网合成的。 395
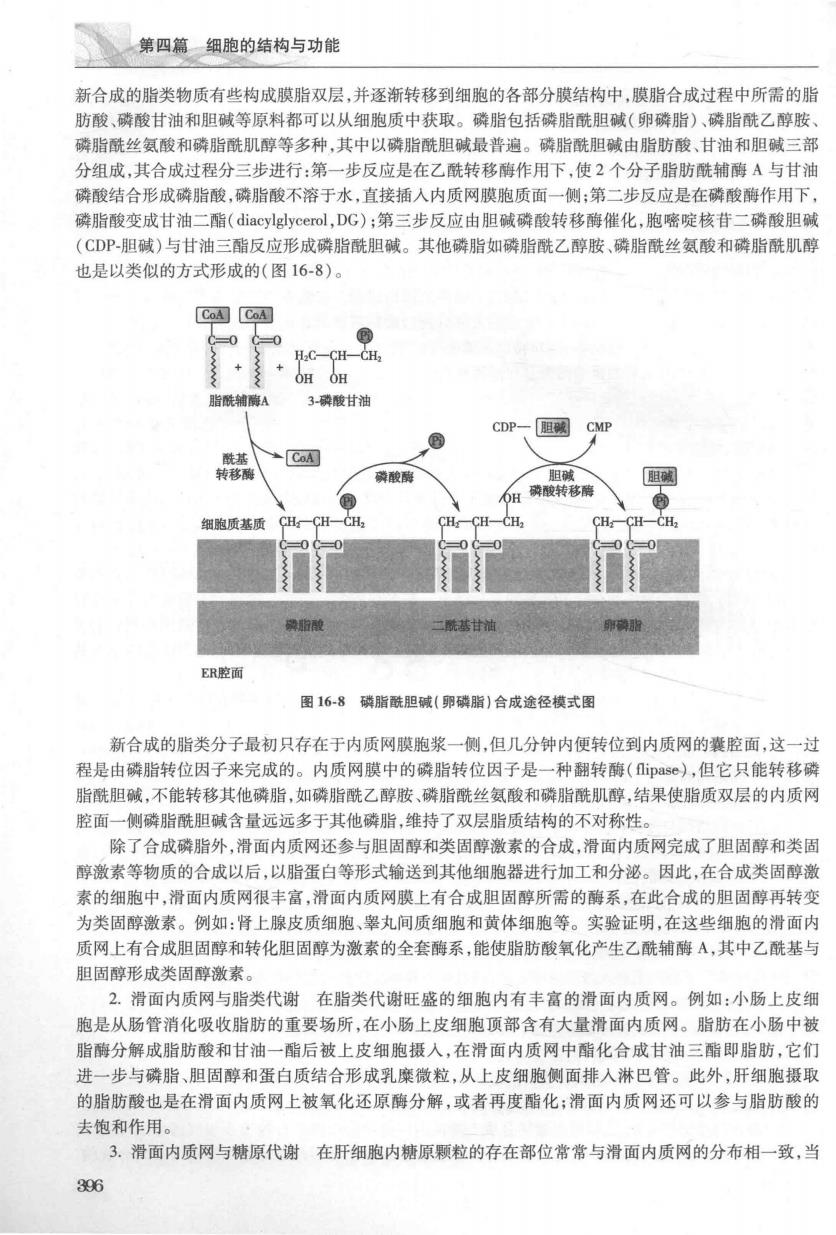
第四篇细胞的结构与功能 新合成的脂类物质有些构成膜脂双层,并逐渐转移到细胞的客部分膜结构中,膜脂合成过程中所需的脂 肪酸,磷酸甘油和胆碱等原料都可以从细胞质中获取。磷脂包括磷脂酰胆碱(卵磷脂)、磷脂酰乙醇胺 曦脂酰丝氨酸和陵脂胜肌醇等多种,其中以磺脂酰胆碱最普骗。磷脂酰胆减由脂肪酸、甘油和胆碱三部 分组成,其合成过程分三步进行:第一步反应是在乙酰转移酶作用下,使2个分子脂肪酰辅酶A与甘油 磷酸结合形成磷脂酸,磷脂酸不溶于水,直接插入内质网膜胞质面一侧:第二步反应是在磷酸酶作用下 破脂酸变成甘油二酯(diacylglycerol,DG):第三步反应由胆碱酸酸转移酶催化,胞嘧啶核苷二硫酸胆碱 (CDP胆碱)与甘油三酯反应形成磷脂酰胆碱。其他磷脂如磷脂酰乙醇胺、,脂酰丝氨酸和磷脂酰肌醇 也是以类似的方式形成的(图16-8) CoA CaA H-C-C CH 3酸甘油 CDP、阻啊CM CoA 磷酸 南酸转移降 细跑质其质CH一CH一CH CH:CH-CH, CH:-CH-CH, 酰基甘油 ER腔面 图16-8碳脂酰胆碱(卵横脂)合成途径掉式图 新合成的脂类分子最初只存在于内质网膜胞浆一侧,但几分钟内便转位到内质网的囊腔面,这一过 程是由磷脂转位因子来完成的。内质网膜中的磷脂转位因子是一种翻转酶(即s©,但它只能转移 脂酰胆碱,不能转移其他磷脂,如磷脂酰乙醇胺、磷脂酰丝氨酸和磷脂酰肌醇,结果使脂质双层的内质网 腔面一侧磷脂酰胆碱含量远远多于其他磷脂,维持了双层脂质结构的不对称性 除了合成磷脂外,滑面内质网还参与胆固醇和类固醇激素的合成,滑面内质网完成了胆固醇和类固 脑激素等物质的合成以后,以脂蛋白等形式输送到其他细胞器讲行加工和卧泌。因此,在合成类固醇 素的细胞中,滑面内质网很丰富,滑面内质网膜上有合成胆固醇所需的酶系,在此合成的胆固醇再转变 为类固醇激素。例如:肾上腺皮质细跑、娶丸间质细胞和黄体细胞等。实验证明,在这些细跑的滑面内 质网上有合成胆固醇和转化胆固醇为激素的全套酶系,能使脂肪酸氧化产生乙酰辅酶A,其中乙酰基与 胆固醇形成类周醇激素 2.滑面内质网与脂类代谢在脂类代谢旺盛的细胞内有丰富的滑面内质网。例如:小肠上皮细 胞是从肠管消化吸收脂肪的重要场所,在小肠上皮细胞顶部含有大量滑面内质网。脂肪在小肠中被 脂酶分解成脂肪酸和甘油一脂后被上皮细胞摄人,在滑面内质网中酯化合成甘油三酯即脂肪,它们 进一步与磷脂、胆固醇和蛋白质结合形成乳糜微粒,从上皮细胞侧面排入淋巴管。此外,肝细胞摄 的脂肪酸也是在滑面内质网上被氧化还原酶分解,或者再度酯化:滑面内质网还可以参与脂肪酸的 去饱和作用。 3.滑面内质网与糖原代谢在肝细胞内糖原颗粒的存在部位常常与滑面内质网的分布相一致,当 396

第十六章细胞内膜系统 糖原颗粒丰富时,滑面内质网被遮盖而不易辨认。在动物被禁食数天之后,糖原减少,滑面内质网明 显可见,提示糖原的代谢似与滑面内质网有关。对于这种现象有不同的解释,有学者认为这是由于 滑面内质网代谢需要能量,可使糖原继发性迁移或聚集;而有的学者认为滑面内质网参与了糖原的 合成和分解 通过对滑面微粒体的生化分析,滑面内质网含有葡萄糖6磷酸酶,与糖原的分解有关。而其他与 糖原合成的酶类均位于细胞溶胶而非滑面内质网。当体内需要化学能时,肝细胞内的糖原在激素的调 控下被磷酸化酶降解为葡萄糖1磷酸,于胞质中再转化为葡萄糖6-磷酸,但质膜对葡萄糖6磷酸具有 不可通透性,因而无法离开肝细胞,也不能被其他细胞所利用。滑面内质网膜中的葡萄糖-6-磷酸酶可 将葡萄糖-6磷酸中的磷酸根脱掉而使其降解为葡萄糖,这样葡萄糖便能穿越内质网膜进入滑面内质网 控,再通膜流系统给送至血液中,以供其他细胞使用 4.滑面内质网与解毒作用 某些脂溶性的代谢产物和药物,具有一定的毒性,而且不能直接被体 内排除,需经过氧化、还原、水解和结合等生物转化过程,使其成为易溶与水的物质而利于排出,这就是 解毒作用(detoxification)。这个生物转化过程主要在滑面内质网上进行。研究表明,滑面内质网中含有 参与这个过程的各种酶系,如还原性辅酶I(NADH)、NADPH-细胞色素c还原酶和细胞色素P450等,其 中细胞色素P450最为重要。细胞鱼素P450相对分子质量为50kDa,为一种末端氧化酶,在肝中具有解 毒作用,它可通过羟基化而使脂溶性废物或代谢产物失活并溶解于水,使一些农药或其他药物失活, 出细胞后送入尿液,从而发挥其解毒作用。服用大量药物的动物,其与解毒有关的酶活性大量增加,引 起滑面内质网增生;但一旦药物消失,多余的滑面内质网便会被溶酶体消化。几天内又恢复至原来的大 小。如给动物服用大量的苯巴比妥,可引起肝细胞内的滑面内质网增生,同时,与解毒作用有关的酶含 量也明显增多。较长期地给动物喂以紫巴比妥,可使肝细跑内的细胞色素P450和NADPH-细胞色素C 还原含量增加50% 100% 5.滑面内质网参与C2·储存和浓度调节。滑面内质网是个多功能的细胞器,在一些特殊的细胞内 可形成特化结构,参与特定的生理过程。如在包括骨骼肌和心肌细胞在内的所有哺乳类动物细胞中形 成一种特化的结构称为肌浆网(sarcoplasmic reticulum),其膜上大量的Ca2泵(Ca2-ATP酶),也称arco olasmic reticulum ca+-ATPase(SERCA),可持续不断地把胞质中的Ca2抽取到内质网腔中,浩成了跨 电化学梯度。SERCA是一种跨膜10次的阳离子转运ATP酶,其结构为四聚体,2端和C2端都位于胞 浆内,似球型结构,能主动把胞浆钙泵人肌浆网内。因此,SERCA在心肌细胞钙稳态的调节中起重要作 用。此外,在肌浆网中还含有捕钙蛋白(calseq i),该蛋白呈强酸性的,对钙具有高度亲和性,实际 上是钙离子的贮存蛋白。因此,当肌肉静息时,肌浆网端池腔中的Ca2“浓度可达(8~10)×10mol/L,为 肌浆中的数千倍。当受到冲动刺激后,肌浆网释放Ca2,引起肌丝收缩:收缩后,肌浆网便利用钙泵讯神 将Ca“从肌浆中予以回收,靠捕钙蛋白将Ca“贮存在肌浆中。 四、内质网与疾病 (一」内质网应激 1。内质网应激的概令当细胞受到外界各种理化因素圳激(如紫外线缺每营养物质缺乏,病壳 氧化应激等),此时细胞内质网功能的内稳态体系被完全打破,内质网由正常状态转变为应激状态,即 内质网应激(endoplasmic reticulum stress,ER stress)。在应激状态下,随着错误折叠和未折叠蛋白在内 质网腔内大量聚集,C2·平衡出现异常。细胞通过激活未折叠蛋白反应等信号通路,直接指导和参与内 质网中异常蛋白质的降解和再折叠,帮助内质网承受并减轻这一压力,维持内质网内环境的稳定,实现 对细胞的保护。内质网应激是细胞内一种话应性机制,持续或过强的内质网应激则诱导细胞周亡浩成 组织损伤。 2.内质网应激的机制内质网应激主要通过三条途径引发应激反应,分别是未折叠蛋白反应 (unfold protein response,UPR)、内质网超负荷反应(endoplasmic reticulum oveload response,EOR)和固醇 397