
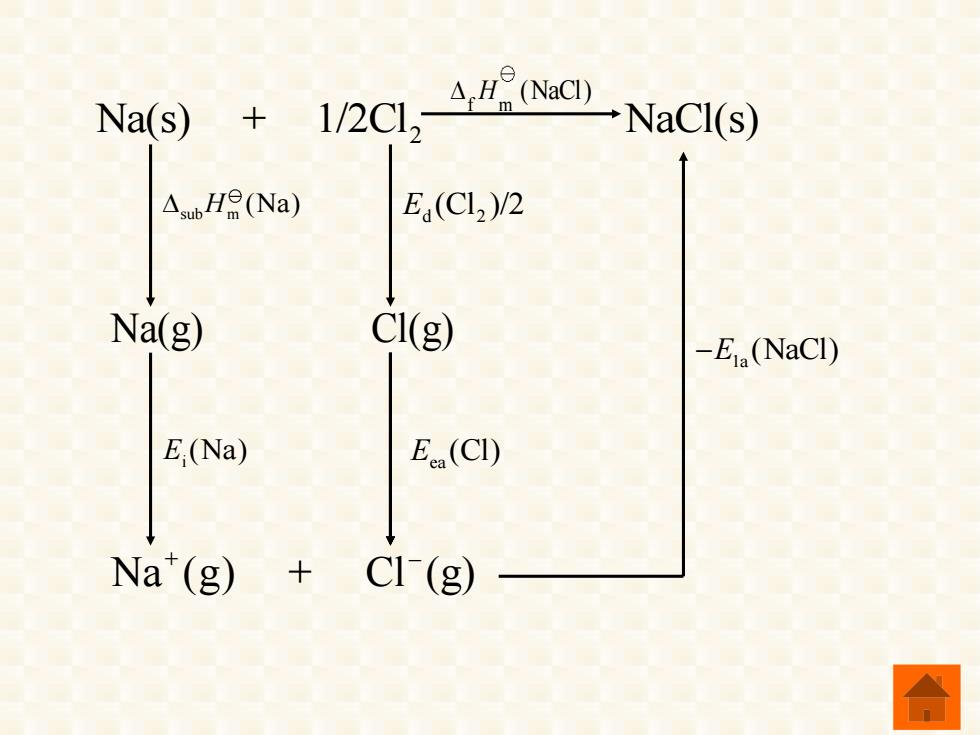
二、晶格能 离子键的强度通常用晶格能来度量。在 标准状态下使单位物质的量离子晶体变为气 态阳离子和气态阴离子时所吸收的能量称为 晶格能,用符号E表示。 晶格能可利用Born-aber循环计算得 到。现以NaCl为例,可以设想反应分为以下 几个步骤进行:
二、晶格能 标准状态下使单位物质的量离子晶体变为气 态阳离子和气态阴离子时所吸收的能量称为 晶格能,用符号 表示。 晶格能可利用Born‐Haber 循环计算得 到。现以NaCl为例,可以设想反应分为以下 几个步骤进行: Ela 离子键的强度通常用晶格能来度量。在
Na(s)+ 1/2C12 △Hn(NaC) →NaCl(s) △bHa(Na)) Ea(CI2)/2 Na(g) CI(g) -Ei (NaCI) E(Na) E (CI) Na*(g) CI-(g)
Na(s) + 1/2Cl NaCl(s) 2 f m H (NaCl) d 2 E (Cl )/2 Na(g) Cl(g) sub m H (Na) i E (Na) ea E (Cl) + Na (g) + Cl (g) − 1a −E (NaCl)

根据Hess定律,NaCl的晶格能为: E.(NaCl)=A.H(Na)+E.(Na)+E(Cl) +Eea(Cl)-△rHa(NaCI) 晶格能是斯量离子键强度的标志。晶格能 越大,离子键强度就越大,熔化或破坏离子晶 体时消耗的能量也就越大,离子晶体的熔点越 高,硬度也越大
根据 Hess 定律,NaCl 的晶格能为: 晶格能是衡量离子键强度的标志。晶格能 越大,离子键强度就越大,熔化或破坏离子晶 体时消耗的能量也就越大,离子晶体的熔点越 高,硬度也越大。 la sub m i d 2 ea f m 1 (NaCl) (Na) (Na) (Cl ) 2 (Cl) (NaCl) E H E E E H = + + + −

三、影响离子型化合物性质的主要因素 由离子键形成的化合物称为离子型化合物。 离子化合物的性质在很大程度上决定于离子键的 强度,而离子键的强度又与离子的半径、离子的 电荷和电子的构型密切相关
三、影响离子型化合物性质的主要因素 离子化合物的性质在很大程度上决定于离子键的 强度,而离子键的强度又与离子的半径、离子的 电荷和电子的构型密切相关。 由离子键形成的化合物称为离子型化合物

(一) 离子半径 与原子一样,单个离子也不存在明确界面。 所谓离子半径,是根据离子晶体中阴、阳离子的 核间距测出的,并假定阴、阳离子的平核间距 为阴、阳离子的半径之和。离子半径可用X射线 衍射法测定,如果已知一个离子的半径,就可求 出另一个离子的半径。 离子半径具有如下规律: (1)同一种元素的阴离子半径大于原子半径; 而阳离子半径小于原子半径,且正电荷越多,半 径越小。例如: r(F)>r(F)r(Fe)<r(Fe2)<r(Fe)
与原子一样,单个离子也不存在明确界面。 所谓离子半径,是根据离子晶体中阴、阳离子的 核间距测出的,并假定阴、阳离子的平衡核间距 为阴、阳离子的半径之和。离子半径可用X 射线 衍射法测定,如果已知一个离子的半径,就可求 出另一个离子的半径。 离子半径具有如下规律: (1)同一种元素的阴离子半径大于原子半径 而阳离子半径小于原子半径,且正电荷越多,半 径越小。例如: (一)离子半径 3 2 r r r r r (F ) (F) (Fe ) (Fe ) (Fe) − + + ;