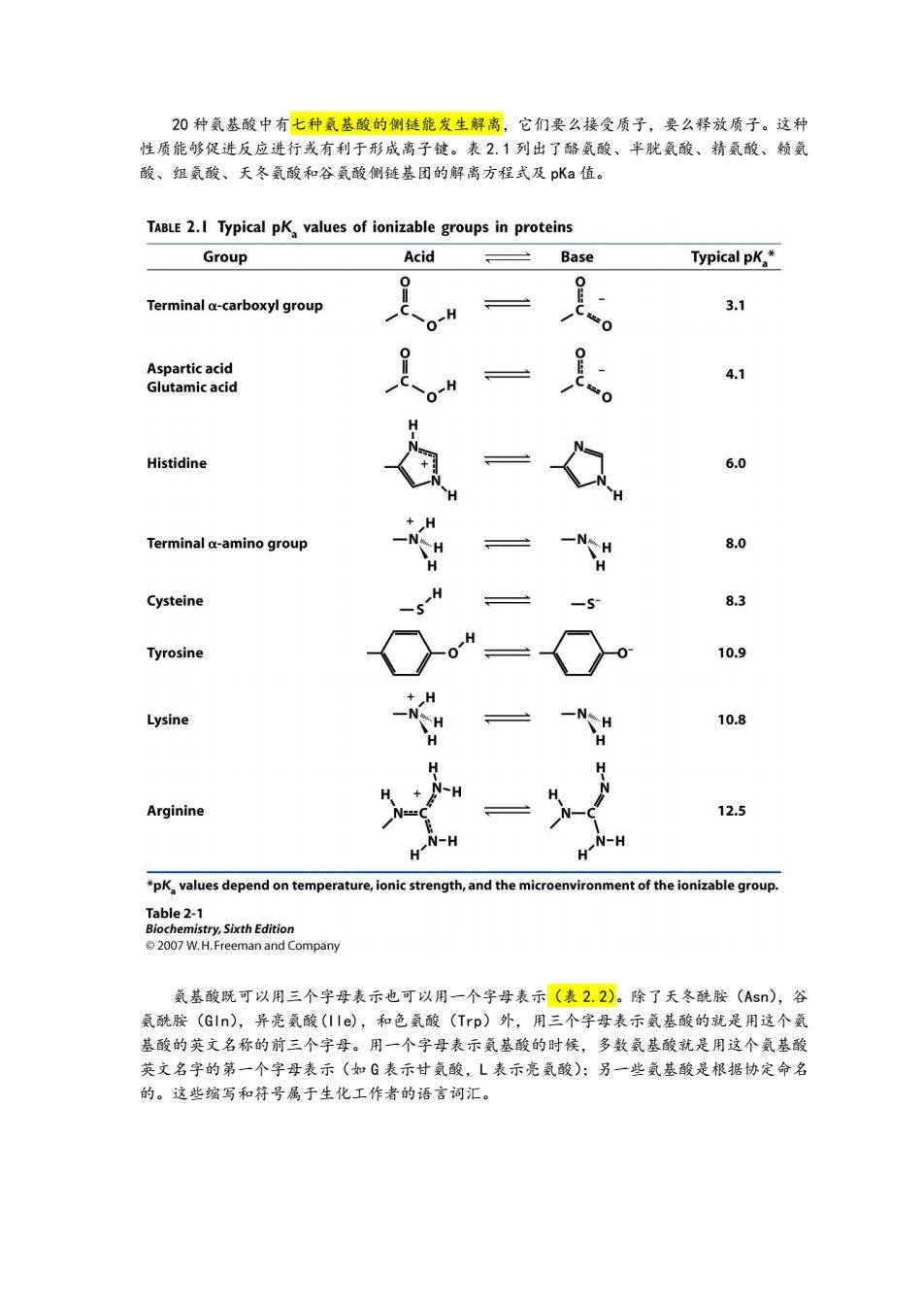
20种氨基酸中有七种氨基酸的侧链能发生解离,它们要么接受质子,要么释放质子。这种 性质能够促进反应进行或有利于形成离子键。表2.1列出了酪氨酸、半胱氨酸、精氨酸、赖氨 酸、组氨酸、天冬氨酸和谷氨酸侧链基团的解离方程式及pKa值。 TABLE 2.I Typical pK values of ionizable groups in proteins Group Acid Base Typical pK* Terminal a-carboxyl group 3.1 Aspartic acid 4.1 Glutamic acid Histidine 6.0 Terminal a-amino group -t 8.0 Cysteine 8.3 Tyrosine 10.9 -N Lysine 10.8 Arginine 12.5 *pK,values depend on temperature,ionic strength,and the microenvironment of the ionizable group. Table 2-1 Biochemistry,Sixth Edition 2007 W.H.Freeman and Company 氨基酸既可以用三个字母表示也可以用一个字母表示(表2.2)。除了天冬酰胺(Asn),谷 氨酰胺(Gln),异亮氨酸(IIe),和色氨酸(Trp)外,用三个字母表示氨基酸的就是用这个氨 基酸的英文名称的前三个字母。用一个字母表示氨基酸的时候,多数氨基酸就是用这个氨基酸 英文名字的第一个字母表示(如G表示甘氨酸,L表示亮氨酸);另一些氨基酸是根据协定命名 的。这些缩写和符号属于生化工作者的语言词汇
20 种氨基酸中有七种氨基酸的侧链能发生解离,它们要么接受质子,要么释放质子。这种 性质能够促进反应进行或有利于形成离子键。表 2.1 列出了酪氨酸、半胱氨酸、精氨酸、赖氨 酸、组氨酸、天冬氨酸和谷氨酸侧链基团的解离方程式及 pKa 值。 氨基酸既可以用三个字母表示也可以用一个字母表示(表 2.2)。除了天冬酰胺(Asn),谷 氨酰胺(Gln),异亮氨酸(Ile),和色氨酸(Trp)外,用三个字母表示氨基酸的就是用这个氨 基酸的英文名称的前三个字母。用一个字母表示氨基酸的时候,多数氨基酸就是用这个氨基酸 英文名字的第一个字母表示(如 G 表示甘氨酸,L 表示亮氨酸);另一些氨基酸是根据协定命名 的。这些缩写和符号属于生化工作者的语言词汇

TABLE 2.2 Abbreviations for amino acids Three-letter One-letter Three-letter One-letter Amino acid abbreviationabbreviation Amino acid abbreviation abbreviation Alanine Ala A Methionine Met M Arginine Arg R Phenylalanine Phe F Asparagine Asn N Proline Pro 0 Aspartic acid Asp D Serine Ser Cysteine Cys C Threonine Thr > Glutamine GIn Q Tryptophan Trp W Glutamic acid Glu Tyrosine Tyr Y Glycine Gly G Valine Val V Histidine His H Asparagine or Asx Isoleucine lle aspartic acid Leucine Leu L Glutamine or Glx Z Lysine Lys 个 glutamic acid Table2-2 Biochemistry,Sixth Edition 2007 W.H.Freeman and Company 氨基酸是如何变成蛋白质原料的?首先氨基酸在结构和化学反应性差异大,使蛋白质式样 多、能够执行各种各样的生物功能。其次这些氨基酸在前生命时期就已经产生。最后,其它可 能出现的氨基酸可能太活泼。例如高丝氨酸和高半胱氨酸易于形成五元环,使蛋白质无法利用 这些氨基酸。而蛋白质中出现的丝氨酸和苏氨酸不会形成环(因为环太小)(图2.17)。 Homoserine Serine 困2.17氯基酸不需要的反应性。有些氨基酸易环化不能充当蛋白组分。高丝氨酸能环化形成 稳定的五元环,导致肽键断裂。丝氨酸环化就会产生有张力的四元环,因此很难环化。X表示 相邻的氨基酸或另一个要离去的基团。 2.2一级结构:肽键连接的氨基酸序列 在蛋白质分子中,一个氨基酸的a-氨基与另一个氨基酸的a-羧基形成肽键。蛋白质就是氨 基酸经肽键连接形成的线形聚合物。两个氨基酸脱水聚合形成二肽(图2.18)。在大多数条件 下这个反应的平衡偏向肽键水解。肽键形成需要输入自由能。但是肽键水解的速度很慢,没有 催化剂时在水中水解肽键需要1000年
氨基酸是如何变成蛋白质原料的?首先氨基酸在结构和化学反应性差异大,使蛋白质式样 多、能够执行各种各样的生物功能。其次这些氨基酸在前生命时期就已经产生。最后,其它可 能出现的氨基酸可能太活泼。例如高丝氨酸和高半胱氨酸易于形成五元环,使蛋白质无法利用 这些氨基酸。而蛋白质中出现的丝氨酸和苏氨酸不会形成环(因为环太小)(图 2.17)。 图 2.17 氨基酸不需要的反应性。有些氨基酸易环化不能充当蛋白组分。高丝氨酸能环化形成 稳定的五元环,导致肽键断裂。丝氨酸环化就会产生有张力的四元环,因此很难环化。X 表示 相邻的氨基酸或另一个要离去的基团。 2.2 一级结构:肽键连接的氨基酸序列 在蛋白质分子中,一个氨基酸的 a-氨基与另一个氨基酸的 a-羧基形成肽键。蛋白质就是氨 基酸经肽键连接形成的线形聚合物。两个氨基酸脱水聚合形成二肽(图 2.18)。在大多数条件 下这个反应的平衡偏向肽键水解。肽键形成需要输入自由能。但是肽键水解的速度很慢,没有 催化剂时在水中水解肽键需要 1000 年
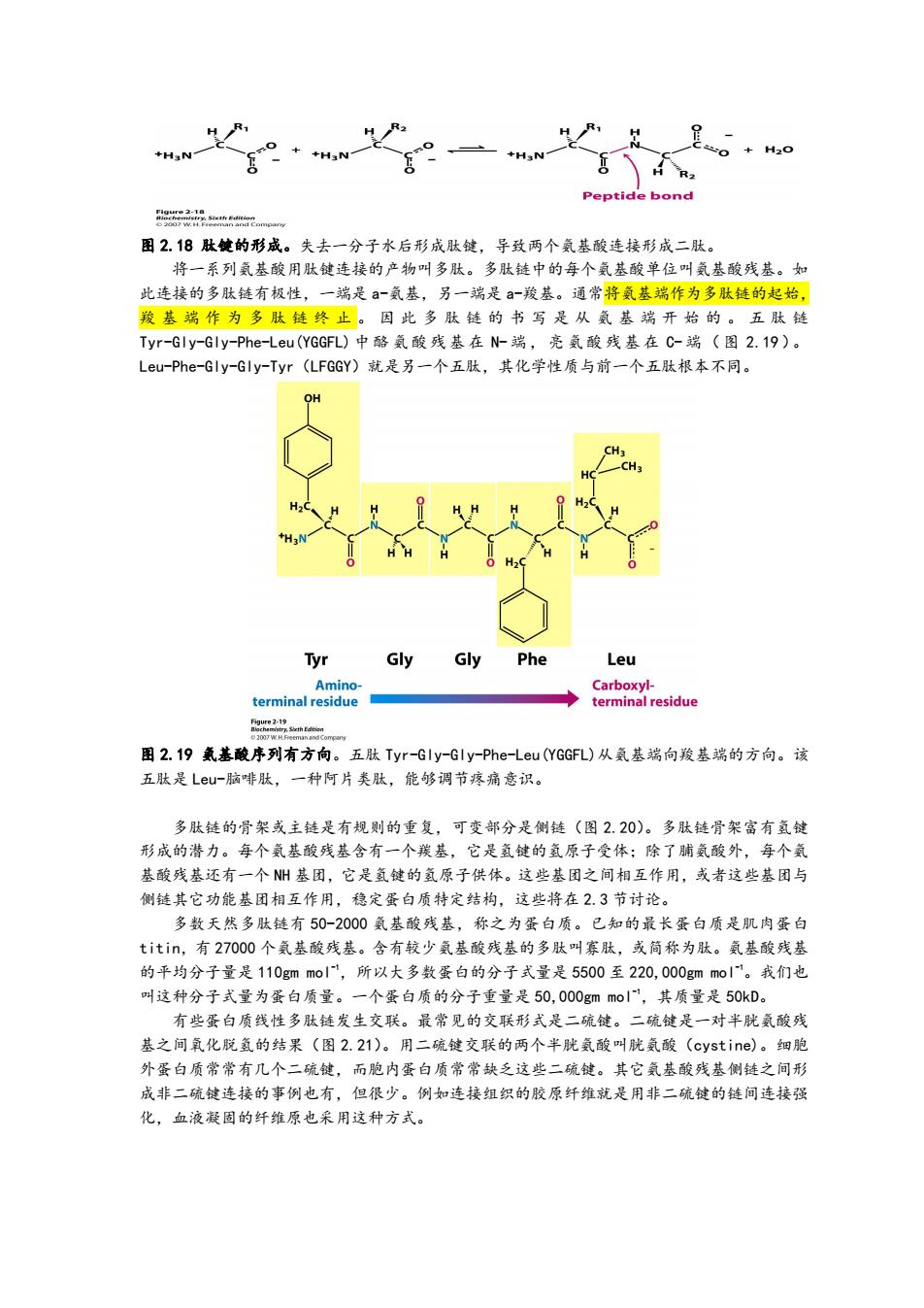
H +H3N +HaN- H2O R2 Peptide bond w 图2.18肽健的形成。失去一分子水后形成肽镀,导致两个氨基酸连接形成二肽。 将一系列氨基酸用肽键连接的产物叫多肽。多肽链中的每个氨基酸单位叫氨基酸残基。如 此连接的多肽链有极性,一端是a-氨基,另一端是a-羧基。通常将氨基端作为多肽链的起始, 羧基端作为多肽链终止。因此多肽链的书写是从氨基端开始的。五肽链 Tyr-Gly-Gly-Phe-Leu(YGGFL)中酪氨酸残基在N端,亮氨酸残基在C-端(图2.19)。 Leu-Phe-Gly-Gly-Tyr(LFGGY)就是另一个五肽,其化学性质与前一个五肽根本不同。 OH CH3 -CH3 H Tyr Gly Gly Phe Leu Amino- Carboxyl- terminal residue terminal residue 图2.19氦基酸序列有方向。五肽Tyr-Gly-Gly-Phe-Leu(YGGFL)从氨基端向羧基端的方向。该 五肽是LeU一脑啡肽,一种阿片类肽,能够调节疼痛意识。 多肽链的骨架或主链是有规则的重复,可变部分是侧链(图2.20)。多肽链骨架富有氢键 形成的潜力。每个氨基酸残基含有一个羰基,它是氢键的氢原子受体:除了脯氨酸外,每个氨 基酸残基还有一个N州基团,它是氢键的氢原子供体。这些基团之间相互作用,或者这些基团与 侧链其它功能基团相互作用,稳定蛋白质特定结构,这些将在23节讨论。 多数天然多肽链有50-2000氦基酸残基,称之为蛋白质。已知的最长蛋白质是肌肉蛋白 titin,有27000个氨基酸残基。含有较少氨基酸残基的多肽叫寡肽,或简称为肽。氨基酸残基 的平均分子量是110 gm mol',所以大多数蛋白的分子式量是5500至220,000 gm mol'。我们也 叫这种分子式量为蛋白质量。一个蛋白质的分子重量是50,000gmmo|',其质量是50kD。 有些蛋白质线性多肽链发生交联。最常见的交联形式是二硫键。二硫键是一对半胱氨酸残 基之间氧化脱氢的结果(图2.21)。用二硫键交联的两个半胱氨酸叫胱氨酸(cystine)。细胞 外蛋白质常常有几个二硫键,而胞内蛋白质常常缺乏这些二硫键。其它氨基酸残基侧链之间形 成非二硫键连接的事例也有,但很少。例如连接组织的胶原纤维就是用非二硫键的链间连接强 化,血液凝固的纤维原也采用这种方式
图 2.18 肽键的形成。失去一分子水后形成肽键,导致两个氨基酸连接形成二肽。 将一系列氨基酸用肽键连接的产物叫多肽。多肽链中的每个氨基酸单位叫氨基酸残基。如 此连接的多肽链有极性,一端是 a-氨基,另一端是 a-羧基。通常将氨基端作为多肽链的起始, 羧 基 端 作 为 多 肽 链 终 止 。 因 此 多 肽 链 的 书 写 是 从 氨 基 端 开 始 的 。 五 肽 链 Tyr-Gly-Gly-Phe-Leu(YGGFL) 中 酪 氨 酸 残 基 在 N- 端 , 亮 氨 酸 残 基 在 C-端 ( 图 2.19)。 Leu-Phe-Gly-Gly-Tyr(LFGGY)就是另一个五肽,其化学性质与前一个五肽根本不同。 图 2.19 氨基酸序列有方向。五肽 Tyr-Gly-Gly-Phe-Leu(YGGFL)从氨基端向羧基端的方向。该 五肽是 Leu-脑啡肽,一种阿片类肽,能够调节疼痛意识。 多肽链的骨架或主链是有规则的重复,可变部分是侧链(图 2.20)。多肽链骨架富有氢键 形成的潜力。每个氨基酸残基含有一个羰基,它是氢键的氢原子受体;除了脯氨酸外,每个氨 基酸残基还有一个 NH 基团,它是氢键的氢原子供体。这些基团之间相互作用,或者这些基团与 侧链其它功能基团相互作用,稳定蛋白质特定结构,这些将在 2.3 节讨论。 多数天然多肽链有 50-2000 氨基酸残基,称之为蛋白质。已知的最长蛋白质是肌肉蛋白 titin,有 27000 个氨基酸残基。含有较少氨基酸残基的多肽叫寡肽,或简称为肽。氨基酸残基 的平均分子量是 110gm mol -1,所以大多数蛋白的分子式量是 5500 至 220,000gm mol -1。我们也 叫这种分子式量为蛋白质量。一个蛋白质的分子重量是 50,000gm mol -1,其质量是 50kD。 有些蛋白质线性多肽链发生交联。最常见的交联形式是二硫键。二硫键是一对半胱氨酸残 基之间氧化脱氢的结果(图 2.21)。用二硫键交联的两个半胱氨酸叫胱氨酸(cystine)。细胞 外蛋白质常常有几个二硫键,而胞内蛋白质常常缺乏这些二硫键。其它氨基酸残基侧链之间形 成非二硫键连接的事例也有,但很少。例如连接组织的胶原纤维就是用非二硫键的链间连接强 化,血液凝固的纤维原也采用这种方式

蛋白质的氨基酸序列是基因决定的 1953年Frederick Sanger确定了胰岛素的氨基酸序列(图2.2),首次证明蛋白质(1)有特 定的氨基酸序列:(2)氨基酸组分是L-型;(3)氨基酸之间的连接是肽键。这项工作是生物化 学的里程碑。该工作的完成促进了其他科学家测定更多蛋白的氨基酸序列。现在序列已知的蛋 白质达200多万。明显的事实是每种蛋白质都有独特的氨基酸序列。蛋白质的氨基酸序列叫蛋 白质的一级结构。 A chain Gly-lle-Val-Glu-GIn-Cys-Cys-Ala-Ser-Val Cys-Ser-Leu-Tyr GI n-Leu-Glu-Asn-Tyr-Cys-Asn 5 10 15 21 B chain Phe-Val-Asn-Gln-His-Leu-Cys-Gly-Ser-His-Leu-Val-Glu-Ala-Leu-Tyr-Leu-Val-Cys-Gly-Glu-Arg-Gly-Phe-Phe-Tyr-Thr-Pro-Lys-Ala 5 10 15 20 25 30 Figure 2-22 Biochemistry,Sixth Edition 2007W.H.Freeman and Company 图2.22牛胰岛素的氢基酸序列。 1950年代后期和1960年代早期的一系列研究证实,蛋白质的氨基酸序列由基因的核苷酸 序列决定。DNA的核苷酸序列确定了RNA分子的核苷酸序列,RNA分子的核苷酸序列又决定了蛋 白质的氨基酸序列。每个氨基酸由一个或多个特定的三核苷酸序列编码(5.5节)。 知道氨基酸序列很重要。(1)蛋白质氨基酸序列信息是阐明该蛋白质作用(如酶的催化作 用)机理所必需的。事实上,已知蛋白质氨基酸序列的变化能产生新的蛋白质特性。(2)蛋白 质的氨基酸序列决定了蛋白质的三维结构。气基酸序列是DNA遗传信息与执行特定生物学功能 的蛋白质三维结构之间的联系。分析蛋白质氨基酸序列与蛋白质三维结构之间的关系能揭示控 制多肽链折叠的规则。(3)序列测定是分子病理学的一个组成部分,而分子病理学是一个发展 迅速医学领域。氨基酸序列改变产生蛋白质异常功能和疾病。蛋白质内单一氨基酸变异会引起 严重的、有时甚至致命的疾病如镰刀细胞贫血病(195)和囊性纤维病变。(4)蛋白质氨基酸序 列能揭示蛋白质的进化史(第六章)。如果蛋白质来自同一祖先,蛋白质之间就很相似。因此进 化史上的分子事件可以根据氨基酸序列追踪:分子古生物学(paleontology)是一个研究热,点。 虽然多肽链有构象限制但仍然可以改变构象 肽骨架的几何形状有几个特征。(1)肽键基本上是平面结构(图2.23)。因此用肽键连接 的一对氨基酸中有六个原子处于同一平面。M端氨基酸的a-碳原子和C0基团,C-端氨基酸的 NH原子和a一碳原子。肽键的本质解释了肽键的平面特性。肽键有双镀性质,阻止了原子围绕双 键的转动从而限制了肽骨架的构型。 XX-X Peptide-bond resonance structures 肽健共振结构 图2.23肽键是平面结构。一对用肽键连接的氨基酸中,六个原子(Ca,C,0,N,H,C)处于同一平 面。氨基酸侧链用绿球标出
蛋白质的氨基酸序列是基因决定的 1953 年 Frederick Sanger 确定了胰岛素的氨基酸序列(图 2.2),首次证明蛋白质(1)有特 定的氨基酸序列;(2)氨基酸组分是 L-型;(3)氨基酸之间的连接是肽键。这项工作是生物化 学的里程碑。该工作的完成促进了其他科学家测定更多蛋白的氨基酸序列。现在序列已知的蛋 白质达 200 多万。明显的事实是每种蛋白质都有独特的氨基酸序列。蛋白质的氨基酸序列叫蛋 白质的一级结构。 图 2.22 牛胰岛素的氨基酸序列。 1950 年代后期和 1960 年代早期的一系列研究证实,蛋白质的氨基酸序列由基因的核苷酸 序列决定。DNA 的核苷酸序列确定了 RNA 分子的核苷酸序列,RNA 分子的核苷酸序列又决定了蛋 白质的氨基酸序列。每个氨基酸由一个或多个特定的三核苷酸序列编码(5.5 节)。 知道氨基酸序列很重要。(1)蛋白质氨基酸序列信息是阐明该蛋白质作用(如酶的催化作 用)机理所必需的。事实上,已知蛋白质氨基酸序列的变化能产生新的蛋白质特性。(2)蛋白 质的氨基酸序列决定了蛋白质的三维结构。氨基酸序列是 DNA 遗传信息与执行特定生物学功能 的蛋白质三维结构之间的联系。分析蛋白质氨基酸序列与蛋白质三维结构之间的关系能揭示控 制多肽链折叠的规则。(3)序列测定是分子病理学的一个组成部分,而分子病理学是一个发展 迅速医学领域。氨基酸序列改变产生蛋白质异常功能和疾病。蛋白质内单一氨基酸变异会引起 严重的、有时甚至致命的疾病如镰刀细胞贫血病(195)和囊性纤维病变。(4)蛋白质氨基酸序 列能揭示蛋白质的进化史(第六章)。如果蛋白质来自同一祖先,蛋白质之间就很相似。因此进 化史上的分子事件可以根据氨基酸序列追踪;分子古生物学(paleontology)是一个研究热点。 虽然多肽链有构象限制但仍然可以改变构象 肽骨架的几何形状有几个特征。(1)肽键基本上是平面结构(图 2.23)。因此用肽键连接 的一对氨基酸中有六个原子处于同一平面。N-端氨基酸的 a-碳原子和 CO 基团,C-端氨基酸的 NH 原子和 a-碳原子。肽键的本质解释了肽键的平面特性。肽键有双键性质,阻止了原子围绕双 键的转动从而限制了肽骨架的构型。 肽键共振结构 图 2.23 肽键是平面结构。一对用肽键连接的氨基酸中,六个原子(Ca,C,O,N,H,Ca)处于同一平 面。氨基酸侧链用绿球标出