
§12.6温度的微观本质 一,理想气体温度与分子平均平动动能的关系 理想气体分子的平均平动动能为 3kT kT 每个分子平均平动动能只与温度有关,与气体的种类无关。 ◆说明 (1)温度是大量分子热运动平均平动动能的度量.它反映了 宏观量T与微观量的统计平均值之间的关系。 (②)温度是统计概念,是大量分子热运动的集体表现。 对于单个或少数分子来说,温度的概念就失去了意义
§12.6 温度的微观本质 一. 理想气体温度与分子平均平动动能的关系 2 2 1 = v kT kT 2 3 3 2 1 = = 理想气体分子的平均平动动能为 每个分子平均平动动能只与温度有关,与气体的种类无关。 说明 (1) 温度是大量分子热运动平均平动动能的度量.它反映了 宏观量T 与微观量ε的统计平均值之间的关系。 (2) 温度是统计概念,是大量分子热运动的集体表现。 对于单个或少数分子来说,温度的概念就失去了意义

二,理想气体定律的推证 1.阿伏加德罗定律 2 3 p=n8=n. NRT p=nkT VN 在相同的温度和压强下,各种气体的分子数密度相等。 2.道尔顿分压定律 设几种气体贮于一密闭容器中,并处于平衡态,且分子数密 度分别为n1、n2、n3., 则 混合气体的分子数密度为 n=n+n+
p n p = nkT 3 2 = n kT 2 3 3 2 = 二. 理想气体定律的推证 T N R V N 0 = 1. 阿伏加德罗定律 在相同的温度和压强下,各种气体的分子数密度相等。 2. 道尔顿分压定律 设几种气体贮于一密闭容器中,并处于平衡态,且分子数密 度分别为 n1 、n2 、 n3 ., 则 混合气体的分子数密度为 = + + 1 2 n n n

温度相同 81=82=.=8 混合气体的压强为 p= n8 48+ =P+P2+ 混合气体的压强等于各种气体的分压强之和
温度相同 = = . = 1 2 混合气体的压强为 = + + 1 1 2 2 3 2 3 2 n n = + + p1 p2 混合气体的压强等于各种气体的分压强之和。 p n 3 2 =

例有一容积为10cm3的电子管,当温度为300K时用真空泵 抽成高真空,使管内压强为5×10mmHg。 求(1)此时管内气体分子的数目;(2)这些分子的总平动动能。 解(①)由理想气体状态方程得 N= pV5×10-6×133.3×10 =1.61×102 kT 1.38×10-23×300 (2)每个分子平均平动动能 兰kT N个分子总平动动能为 Nc=N.3kT=10*J 2
有一容积为10cm3 的电子管,当温度为300K时用真空泵 抽成高真空,使管内压强为5×10-6 mmHg。 (1) 此时管内气体分子的数目;(2) 这些分子的总平动动能。 解 例 求 1.38 10 300 5 10 133.3 10 23 6 5 = = − − − kT pV N 12 =1.6110 (1) 由理想气体状态方程得 (2) 每个分子平均平动动能 kT 2 3 = N 个分子总平动动能为 10 J 2 3 −8 N = N kT =
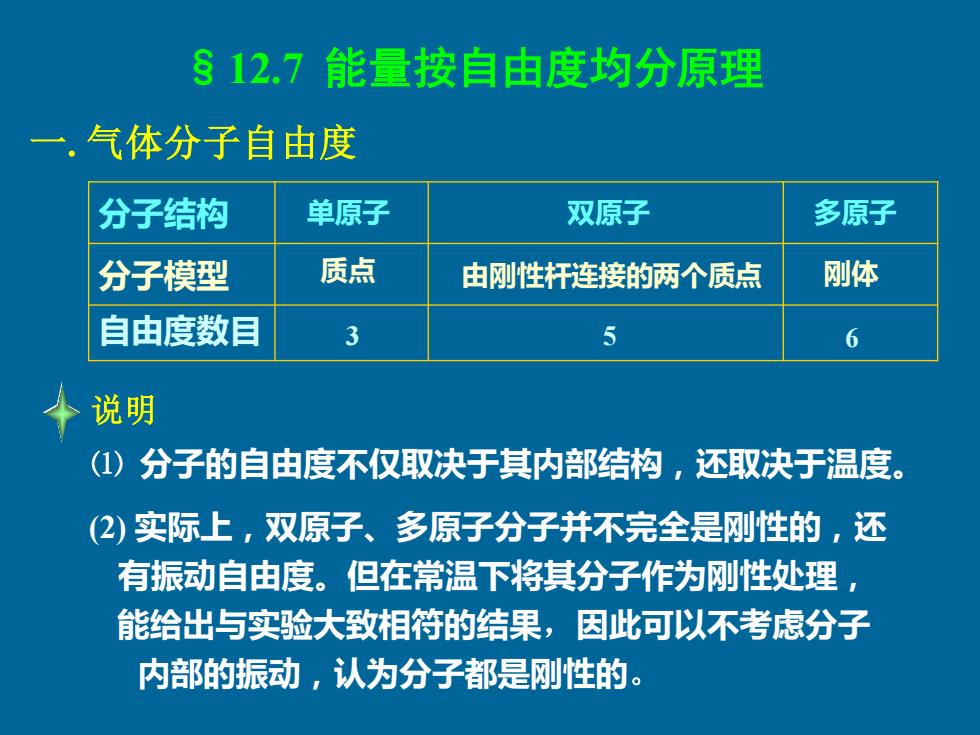
§12.7能量按自由度均分原理 一.气体分子自由度 分子结构 单原子 双原子 多原子 分子模型 质点 由刚性杆连接的两个质点 刚体 自由度数目 3 5 6 说明 ()分子的自由度不仅取决于其内部结构,还取决于温度。 (2)实际上,双原子、多原子分子并不完全是刚性的,还 有振动自由度。但在常温下将其分子作为刚性处理, 能给出与实验大致相符的结果,因此可以不考虑分子 内部的振动,认为分子都是刚性的
§12.7 能量按自由度均分原理 一. 气体分子自由度 分子结构 分子模型 自由度数目 单原子 双原子 多原子 说明 ⑴ 分子的自由度不仅取决于其内部结构,还取决于温度。 3 5 6 质点 由刚性杆连接的两个质点 刚体 (2) 实际上,双原子、多原子分子并不完全是刚性的,还 有振动自由度。但在常温下将其分子作为刚性处理, 能给出与实验大致相符的结果,因此可以不考虑分子 内部的振动,认为分子都是刚性的