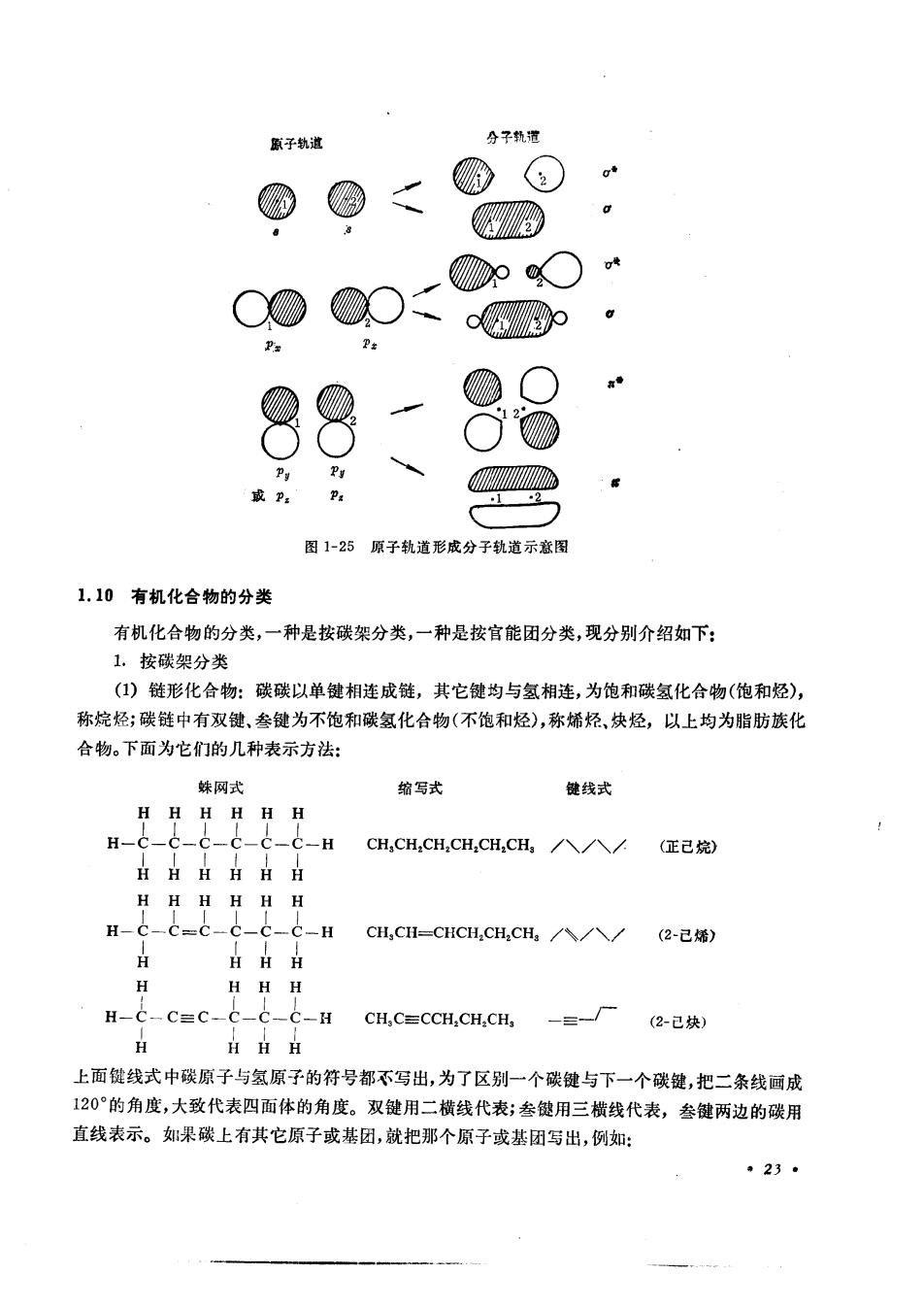
照子轨道 分子轨道 肠 a 网 3 ☑○* 0 2 p。 Pr amm 图1-25原子轨道形成分子轨道示意图 1.10有机化合物的分类 有机化合物的分类,一种是按碳架分类,一种是按官能团分类,现分别介绍如下: 1.按碳架分类 (1)链形化合物:碳碳以单键相连成链,其它键均与氢相连,为饱和碳氢化合物(饱和烃), 称烷烃;碳链中有双键、叁键为不饱和碳氢化合物(不饱和烃),称烯烃、决烃,以上均为脂肪族化 合物。下面为它们的几种表示方法: 妹网式 缩写式 健线式 HHH HH H H-c-c-c-c- -C-H CH,CH,CH,CH,CH,CH八八/(正己) HHHHHH H HHH HH H-C=c-c-C-Hc,c=CHcH,cH,cH,八八/-w) H HH H H HHH -C=C-C-C-C-H CH,CECCH,CH,CH, (2-己炔) HHH 上面键线式中碳原子与氢原子的符号都不写出,为了区别一个碳键与下一个碳键,把二条线画成 120°的角度,大致代表四面体的角度。双键用二横线代表;叁键用三横线代表,叁键两边的碳用 直线表示。如果碳上有共它原子或基团,就把那个原子或基团写出,例如: 23
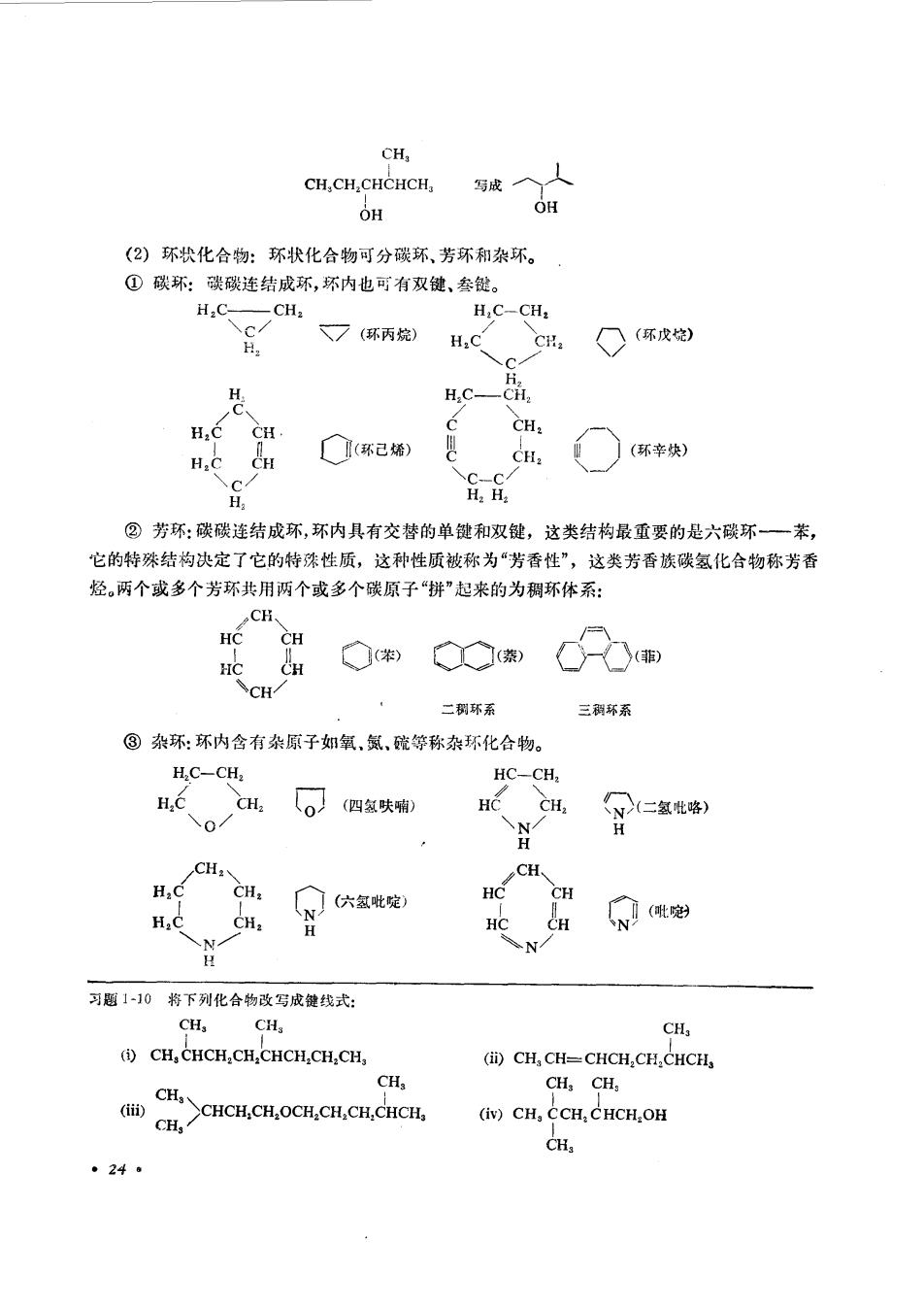
CH, CH.CH.CHCHCH OH OH (2)环状化合物:环状化合物可分碳环,芳环和杂环。 ①碳环:谈碳连结成环,环内也可有双键、参健。 H;C- CH. H,C-CH: 7(环丙烷) H.C CH. ○(环戊伦) H.C H,C CH CH. H.C CH (环己烯 CH )(环幸炔) H ②芳环:碳碳连结成环,环内具有交替的单键和双键,这类结构最重要的是六碳环一苯, 它的特殊结构决定了它的特殊性质,这种性质被称为“芳香性”,这类芳香族碳氢化合物称芳香 烃两个或多个芳环共用两个或多个碳原子“拼”起来的为稠环体系: HC CH HC CH G CH 二稠环系 三稠环索 ®杂环:环内含有杂原子如氧,氮,疏等称杂环化合物。 H.C-CH2 HC-CH, H.C CH 。四氢失釉 o/ HC CH. 骨=室) CH, CH. H.C CH: 六氢定 HC CH CH: HC CH N饿 可题1-10将下列化合物改写成键线式: CH. CH. CH, (i)CH,CHCH CH,CHCH CH:CH, (ii)CH,CH=CHCH.CH.CHCH CH, CHCH.CH.OCB.CH.CH.CHCH, CH,CH, (曲) CH. (iv)CH,CCH.CHCH OH CH ·24

(W)HC CH CHCH,CH, HCCHCCN. H:C- -CH: CH (vii) HC )CCH CH-CH 2.按官能团分类 碳氢化合物上的氢用各种不同基团取代后的化合物,被看作是碳氢化合物的衍生物,它们具 有不同性质,这些基团,称为官能团,含官能团的化合物易受不同试剂进攻,发生不同反应,含 有相同官能团的化合物或多或少具有相同的性质。因此根据不同官能团,又可把有机化合物分 为若干类。现把最重要的官能团列于表1-2。表中R表示烷基,看作一个饱和烃去掉一个氢的我 表1-2雕要官能团 称 名称 C=C >C-N-R 亚氨 -CEC- C=N-NH 羟卤 C=N-OH 0 -OH -0-0-C 过氧热 酰基 -0X 女肉基 肤幽基 _NH-NH 酯基 酸酐基 基(甲酰基 酰氨基 -NHR 醛基 三级酰氨基 缩阴 -SO.H 25

基。例如CH。一(甲基),C,H。一(乙基),基的英文名是Radical,R是该字的第一个字母。当分子 中有不同烷基时用R和R'加以区别。一个分子式中出现这个符号时,该式就是一个通式,不论 R的大小和结构有什么不同,假定它们都具有某种程度上类似性。 1.11有机反应的类型 按反应时键的断裂方式,可分为均裂与异裂两类反应,此外还有协同反应。 l.均裂反应(homolytic reaction). 健断裂时成健的一对电子平均分给两个原子或基团,如: ABA十B 2C1,+H,C马H→H,CC1+CI 这种断裂方式称均裂,均裂时生成的原子或基团带有一个孤单电子,用黑点表示,如H,C,H·,称 自由基(free radical,或称游离基),它是电中性的。自由基多数只有瞬间寿命,是活性中间体中 的一种。这类反应一般在光、热或自由基引发剂的作用下进行。这种分子经过均裂而发生的反 应称自由基反应(free radical reaction)。自由基反应的特点是没有明显的溶剂效应,酸,碱等 催化剂对反应没有明显影响,反应有一个诱导期,加一些能与自由基偶合的物质(阻抑剂),反应 可被停止。 2.异裂反应(heterolytic reaction) 能断裂时原来一对成键电子为某一原子或基团所占有,如: A:BA+:B CH),C:C1→(CH),C+:C 这种断裂方式称异裂,生成正离子(cation)和负离子(anion),反应往往在酸、碱或极性物质(如 极性溶剂)催化下进行,一般离子也只有瞬间寿命,也是活性中间体中的一种。这种经过异裂生 成离子的反应称为离子型反应((ionic reaction)。 离子型反应根据反应试剂的类型不同,又可分为亲电反应(electrophilic reaction).与亲核 反应(nucleophilic reaction)两类: 亲电反应:反应试剂很需要电子或“亲近"电子,容易与被反应的化合物中能提供电子的部 位发生反应,例如: HBr+RCiH=CH,→RC-CH+Br一RCHCH, 来电试剂 Br 首先是由H·与电荷密鹿较大的C-1结合,然后B~与C-2结合。此反应是先由缺电子试 剂与具有部分负电荷的碳原子发生的,这个试剂,称为亲电试剂(electrophile或electrophilic re9gent),与亲电试剂发生的反应称亲电反或。 在反应中与试剂发生反应的化合物称为底物,上述反应中RCHCH:就是底物。 26

亲核反应:试剂能提供电子,容易与底物中较电正性的部位发生反应,如: N +RCHCI -RCHCN CI- 表核试剂 首先由~CN进攻与氯原子相连的带有部分正电荷的碳原子,氯原子带着一对电子离去。这类能 提供电子的试剂,称亲核试剂(nucleophile或nucleophilic reagent)),由亲核试剂进攻而发生的 反应称亲核反应 3.协同反应(concerted reaction) 协同反应是在60年代根据过去已知的很多反应总结成的一类反应,所谓协同反应是起反应 的分子一单分子或双分子一发生化学键的变化,反应过程中只有键变化的过渡态,一步发生 成键和断键,没有自由基或离子等活性中间体产生。简单地说协同反应是一步反应,可在光或热 作用下发生。协同反应往往有一个环状过渡态,如双烯合成反应经过一个六元环过渡态,不存在 中间步骤: (+1[O◇ 环状过渡志 1.12酸碱的概念 目前广泛应用于有机化学中的两个酸碱理论是勃朗斯德(Br6 nsted,J.N.)酸碱理论和路易 斯酸碱理论。简单介绍如下: 1.勃朗斯德酸職理论 根据勒朗斯德酸碱定义,酸是质子的给予体(给体),碱是质子的接受体(受体): NH+H一NH 共轭飘 碱 共矩酸 一个酸释放质子后产生的酸根,即为该酸的共轭碱,一个碱与质子结合后形成的质子化物,即为 该碱的共轭酸,如: 酸 碱的共栀酸酸的共矩 CH,COH H,o H,o CH,COO H,O+CH,NH一CH,NH,+OH H,SO.CH,OH -CH,OH:+HSO 酸的强度,可以在很多溶剂中测定,但最常用的是在水溶液中,通过酸的离解常数K。来测 定的: 。27