
个原子结合起来形成共价健,这就是共价键的一种近似的处理方法。 将最子力学对氢分子共价健的讨论定性地推广到其它双原子或多原子分子的共价键,通过 近似方法的计算,也可以得到与实验很接近的结果,近似法中的一种,即价键理论,其主要内容 如下: (1)如两个原子各有一个未成对电子且自旋反平行,就可偶合配对,成为一个共价键。如原 子各有两个或参个未成对电子,可以形成双键或参键。因此原子的未成对电子数就是它的原子 的价数。 (2)如果一个原子的未成对电子已经配对,就不再能与其它原子的未成对电子配对,这就是 共价键的饱和性。所以一个具有n个未成对电子的原子A可以和%个只具有一个未成对电子的 原子B结合形成ABn (3)电子云重叠愈多,形成的锥愈强,即共价锦的键能与原子轨道重叠程度成正比。因此要 尽可能在电子云密度最大的地方重叠,这就是共价键的方向性。例如1s轨道与2印.轨道在x轴 方向有最大的重叠,可以成键。如图1-13()轨道有最大的重叠,()不是最大的重叠: 1:轨道与2轨道最大重叠 不是最大重香 (D 图1-132印轨道与14轨道及2印轨道之间的重叠 这种沿健轴方向电子云重叠而形成的轨道,电子云分布沿键轴呈圆柱形对称,称σ轨道,生成的 键,称σ键,例如S一S,8一P,P。一P均为g键。两个原子的p轨道平行,侧面电子云有最大的 重叠,形成的轨道称x轨道,生成的健称x键,如图1-13()所示。产键电子云密度在两个原子 键轴平面的上方和下方较高,键轴周围较低,π健的健能小于σ键。 (4)能量相近的原子轨道可进行杂化,组成能量相等的杂化轨道,这样可使成键能力更强, 体系能量降低,成键后可达到最稳定的分子状态。例如碳原子外层(2s)2(2)'(2印,)四个电子, 其中(2)中一个电子跃迁到(2)轨道中,然后四个轨道杂化: 杂化后形成四个能量相等的杂化轨道,称s杂化轨道,其立体形状如图1-14所示。2p轨道有 两瓣,波函数符号不同,与2s轨道杂化后,波函数符号相同的一瓣增大了,不同的一瓣缩小了,因 此每一个杂化轨道绝大部分电子云巢中在一个方向,在另一个方向电子云较少,这样,一个轨道 的方向性就加强了,可以与另一个轨道形成一个更强的键。为了使彼此达到最大的距离及最小 的干扰,碳原子的四个8轨道在空间采取一定的排列方式,就是以碳原子为中心,四个轨道分 别指向正四面体的每-·个顶点,有一定方向性,轨道彼此间保持着一定的角度,按计算应该是 18

109.5°,这与范霍夫的计算是一致的,具体化合物可以稍有出入。 一个轨道 护锁道电子等密度线 四个意杂化轨消 图1-14一个。轨道与三个p轨道形成四个$7杂化轨道 除了sp杂化外,还可以有sp2杂化及s?杂化。例如铍(B)的电子构型为(1s)2(2s),没 有未成对电子,但铍可以与两个氯形成二氯化皱(BC12),这说明皱是二价的。这是因为一个2 电子激发到2印轨道,杂化形成两个能量相当的8P杂化轨道,每个轨道具有1/2s成分与1/2印成 分。为了使两个轨道具有最大的距离和最小的干扰,两个轨道处在同一条直线上,但其方向相 反,如图1-15所示。因此铍在sp轨道对称轴方向与两个氯形成C1-Be一C,是个直线型的化 合物。 又如硼(B)的电子构型为(1s)(28)?(2),只有一个未成对电子,但它能与三个氟原子结合 形成三氟化硼,说明硼是三价的。这是因为有一个2s电子激发到2印轨道,然后由一个2s轨道与 两个2p轨道杂化,形成三个能量相当的8P2杂化轨道,每个8p2杂化轨道具有1/3s成分与2/3P 成分。为了使三个轨道具有最大的距离和最小的干扰,三个轨道具有平面三角形的结构,如图 1-16所示。硼的三个杂化轨道与三个氟原子成键,形成三氟化硼分子,三个B一F键在同一平面 上,键角为120°。 图1-15一个&轨道和一个卫轨道杂化 图1- 个。轨道与两个卫轨道 形成的两个8鄂化轨道 形成三个$P杂化轨道 价键理论是总结了很多化合物的性质、反应,同时又运用了量子力学对原子及分子的研究成 果而发展起来的,在认识化合物的结构与性能关系上起了指导作用,对问题的说明比较形象,容 易明了并易于接受,因此价键理论发展较早,现在仍在使用。但此理论的局限性在于它只能用米 表示两个原子相互作用而形成的共价键,即分子中的价电子,是被定城在一定的化学键的两个原 子核区域内运动(电子定域),因此对单键、双键交替出现的多原子分子形成的共价健(共轭双键) 就无法形象地表示,出现的现象也无法解释,后来发展起来的分子轨道理论,对这些问题有比较 。19

满意的解释。 1.9分子轨道理论 量子力学处理氢分子共价健的方法,推广到比较复杂分子的另一种理论是分子轨道理论,共 主要内容如下: 分子中电子的运动状态,即分子轨道,用波函数中表示。分子轨道理论中目前最广泛应用的 是原子轨道线性组合法。这种方法假定分子轨道也有不同能层,每一轨道也只能容纳两个自旋 相反的电子,电子也是首先占据能量最低的轨道,按能量的增高,依次排上去。按照分子轨道理 论,原子轨道的数目与形成的分子轨道数目是相等的,例如两个原子轨道组成两个分子轨道,其 中一个分子轨道是由两个原子轨道的波函数相加组成,另一个分子轨道是由两个原子轨道的波 函数相减组成: =1十 中:与抑分别表示两个分子轨道的波函数,中,与中2分别表示两个原子轨道的被函数。 在分子轨道,中,两个原子轨道的波函数的符号相同,亦即波相相同,它们之间的作用犹如 波蜂与波峰相遇相互加强一样,见图1-17: (+) 1一7-2 图1-17波相相同的被(或被函数)之间的相互作用 在分子轨道中2中,两个原子轨道的波函数符号不同,亦即波相不同,它们之间的作用犹如菠 峰与波谷相遇相互减弱一样,波峰与波谷相遇处出现节点(见图1-18)。 (1- 图1-18被相不同的放(或波函数)之问的相互作用 两个分子轨道波函数的平方,即为分子轨道电子云密度分布,如图1-19所示。 图1-19分子轨道的电子云密度分布(对键轴的》图 20

从图1-19可以看出,分子轨道中,在核间的电子云密度很大,这种轨道称为成键轨道。分 寸轨道中2,在核间的电子云密度很小,达种轨道称为反键轨道。成键轨道和反键轨道的电子云 松皮分布亦可用等密度线表示,如图1-20所示。 成健轨道好 反键轨近中: 图1-20分子轨道电子云密度分布图(用第密度线表示) 图1-20为截面图,沿键轴旋转一周,即得立体图。图中数字是的2数值,由外往里,数字逐渐 增大,电子云密度亦逐渐增大。反键轨道在中间有一节面,节面两侧波函数符号相反,在节面上 电子云密度为零。 成能轨道与反键轨道对于键轴均呈圆柱形对称,因此它们所形成的健是σ健,成键轨道用。 表示,反键轨道用σ*表示。例如氢分子是由两个氢原子的18轨道组成一个成键轨道(用σ,表 示)和一个反键轨道(用i:表示)。 圈+© 图 +圈-验-. 图1-21氢分子轨道示意图 根据理论计算,成键轨道的能量较两个原子轨道的能量低,反健轨道的能量较两个原子轨道 的能量高。可以这样来理解,成键轨道电子云在核与核的中间密度较大,对核有吸引力,使两个 楼接近而降低了能量,而反键轨道的电子云在核与核的中间很少,主要在核的外侧对核吸引,使 两核远离,同时两个核又有排斥作用,因而能量增加。分子中的电子排布时,根据鲍里原理及能 量最低原理,应占据能量较低的分子轨道,例如氢分子中两个1©电子,占据成键轨道且自旋反平 行,而反键轨道是空的,图1-22所示是氢分子基态的电子排布。 因此,分子轨道理论认为:电子从原子轨道进人成键的分子轨道,形成化学健,从而使体系的 能量降低,形成了稳定的分子。能量降低愈多,形成的分子愈稳定。 原子轨道组成分子轨道还必须具备能量相近、电子云最大重叠以及对称性相同三个条件。 (1)所谓能量相近就是指组成分子轨道的两个原子轨道的能量比较接近,这样,才能有效地 成键,如图1-22所示。如氯原子与氟原子组成氟化氢分子,氢原子的18轨道与氟原子的哪一 个轨道能量相近?氟原子的电子构型为(1s)(28)”(2)5。由于的核电荷比氢的核电荷多 。210
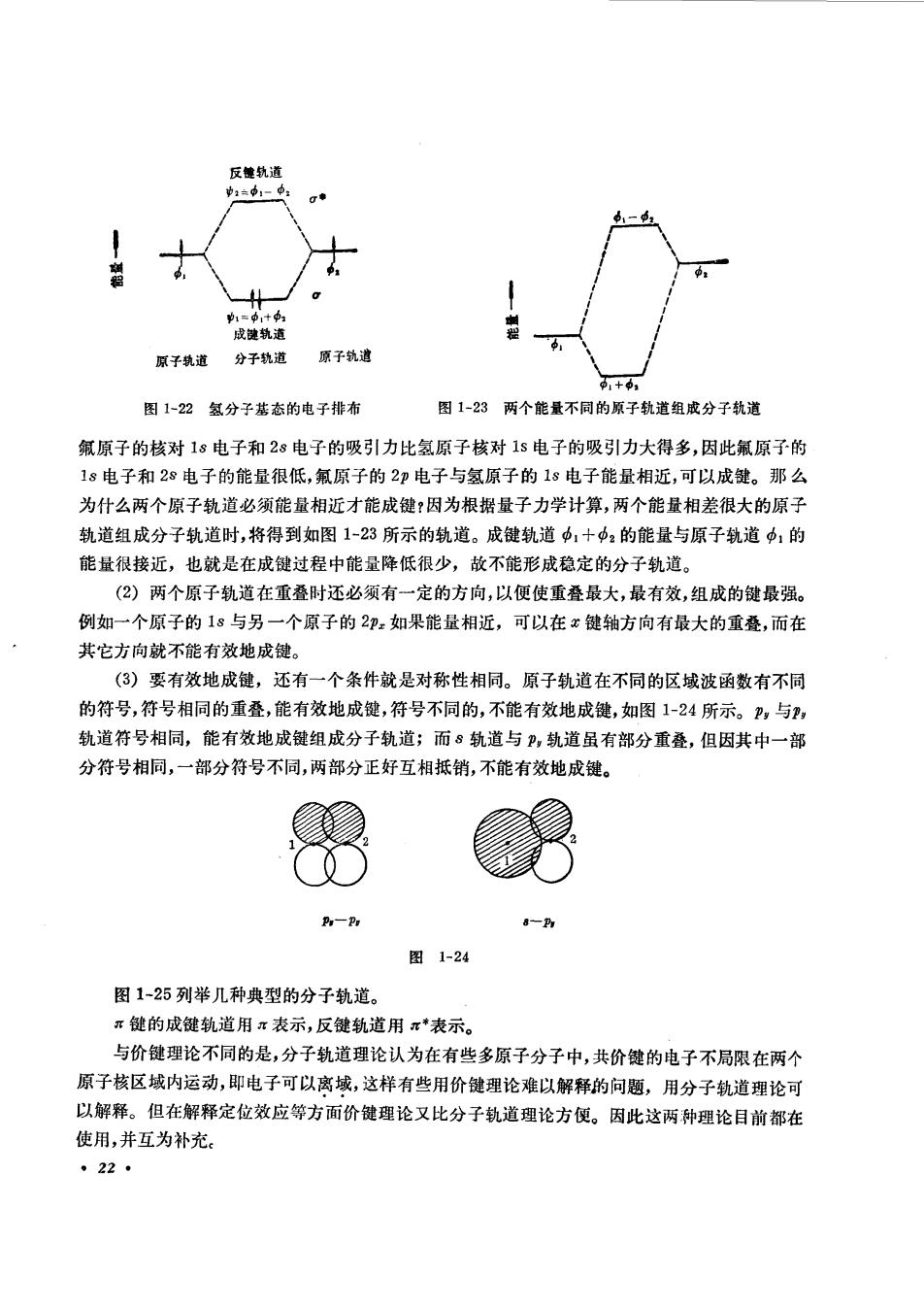
成捷轨道 原子道 分子轨道原子钱通 图1-2氢分子基态的电子排布 图1-23两个能量不同的原子轨道组成分子轨道 氟原子的核对1s电子和28电子的吸引力比氢原子核对1s电子的吸引力大得多,因此氟原子的 1s电子和2s电子的能量很低,氟原子的2印电子与氢原子的1s电子能量相近,可以成健。那么 为什么两个原子轨道必须能量相近才能成键?因为根据量子力学计算,两个能量相差很大的原子 轨道组成分子轨道时,将得到如图1-23所示的轨道。成健轨道中1+中:的能量与原子轨道中1的 能量很接近,也就是在成键过程中能量降低很少,故不能形成稳定的分子轨道。 (2)两个原子轨道在重叠时还必须有一定的方向,以便使重叠最大,最有效,组成的键最强。 例如一个原子的1s与另一个原子的2印如果能量相近,可以在x键轴方向有最大的重叠,而在 其它方向就不能有效地成键。 (3)要有效地成键,还有一个条件就是对称性相同。原子轨道在不同的区域波函数有不同 的符号,符号相同的重叠,能有效地成键,符号不同的,不能有效地成键,如图1-24所示。,与, 轨道符号相同,能有效地成键组成分子轨道;而8轨道与卫,轨道虽有部分重叠,但因其中一部 分符号相同,一部分符号不同,两部分正好互相抵销,不能有效地成键。 0 A一h 8一A 图1-24 图1-25列举几种典型的分子轨道。 ”键的成键轨道用π表示,反键轨道用π表示。 与价键理论不同的是,分子轨道理论认为在有些多原子分子中,共价键的电子不局限在两个 原子核区城内运动,即电子可以离域,这样有些用价键理论难以解释的问题,用分子轨道理论可 以解释。但在解释定位效应等方面价健理论又比分子轨道理论方便。因此这两种理论目前都在 使用,并互为补充。 。22·