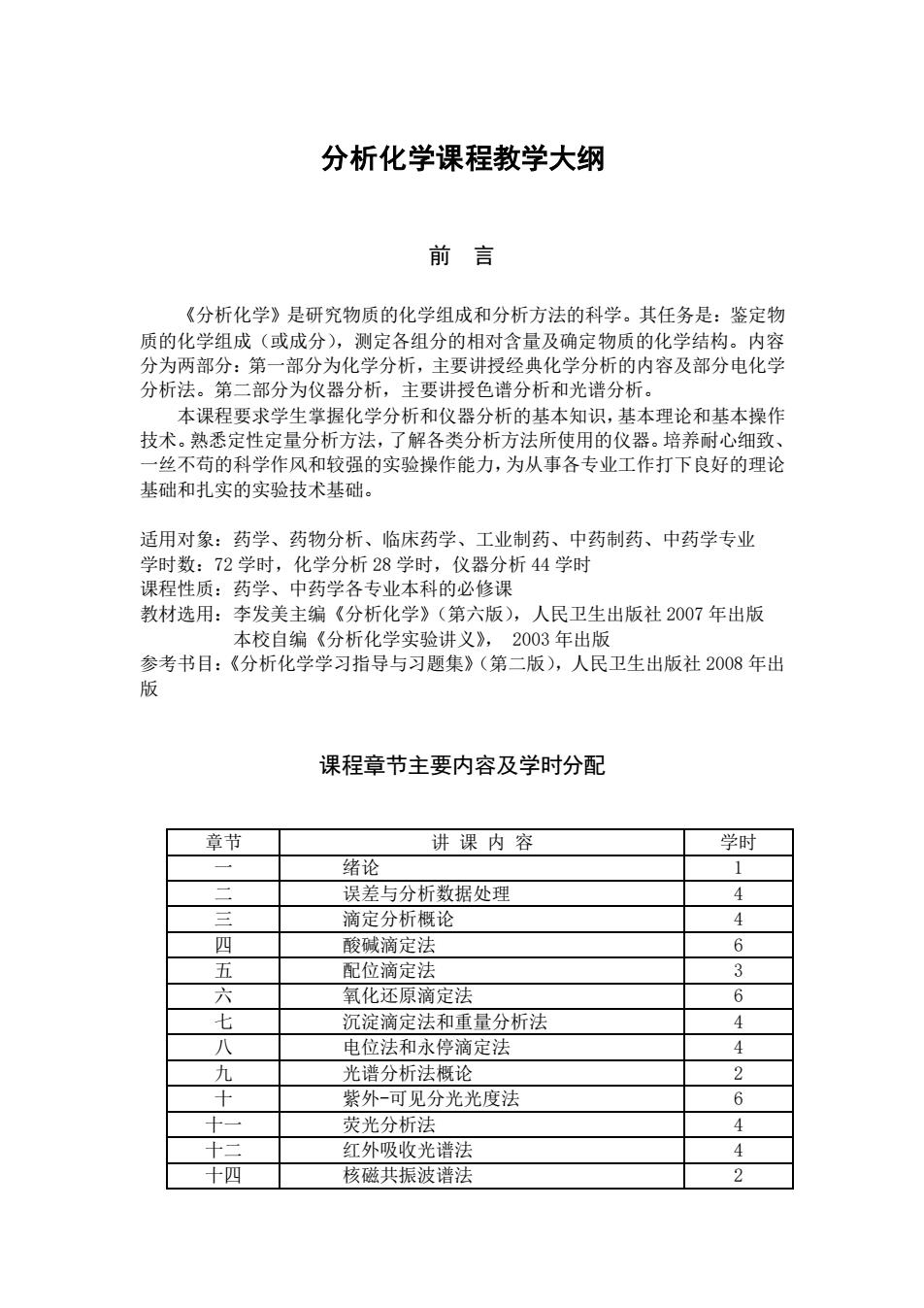
分析化学课程教学大纲前言《分析化学》是研究物质的化学组成和分析方法的科学。其任务是:鉴定物质的化学组成(或成分),测定各组分的相对含量及确定物质的化学结构。内容分为两部分:第一部分为化学分析,主要讲授经典化学分析的内容及部分电化学分析法。第二部分为仪器分析,主要讲授色谱分析和光谱分析。本课程要求学生掌握化学分析和仪器分析的基本知识,基本理论和基本操作技术。熟悉定性定量分析方法,了解各类分析方法所使用的仪器。培养耐心细致、一丝不苟的科学作风和较强的实验操作能力,为从事各专业工作打下良好的理论基础和扎实的实验技术基础。适用对象:药学、药物分析、临床药学、工业制药、中药制药、中药学专业学时数:72学时,化学分析28学时,仪器分析44学时课程性质:药学、中药学各专业本科的必修课教材选用:李发美主编《分析化学》(第六版),人民卫生出版社2007年出版本校自编《分析化学实验讲义》,2003年出版参考书目:《分析化学学习指导与习题集》(第二版),人民卫生出版社2008年出版课程章节主要内容及学时分配学时章节讲课内容绪论二误差与分析数据处理4三滴定分析概论4酸碱滴定法四配位滴定法3氧化还原滴定法六沉淀滴定法和重量分析法4八电位法和永停滴定法4光谱分析法概论J紫外-可见分光光度法6荧光分析法4红外吸收光谱法4十四核磁共振波谱法
分析化学课程教学大纲 前 言 《分析化学》是研究物质的化学组成和分析方法的科学。其任务是:鉴定物 质的化学组成(或成分),测定各组分的相对含量及确定物质的化学结构。内容 分为两部分:第一部分为化学分析,主要讲授经典化学分析的内容及部分电化学 分析法。第二部分为仪器分析,主要讲授色谱分析和光谱分析。 本课程要求学生掌握化学分析和仪器分析的基本知识,基本理论和基本操作 技术。熟悉定性定量分析方法,了解各类分析方法所使用的仪器。培养耐心细致、 一丝不苟的科学作风和较强的实验操作能力,为从事各专业工作打下良好的理论 基础和扎实的实验技术基础。 适用对象:药学、药物分析、临床药学、工业制药、中药制药、中药学专业 学时数:72 学时,化学分析 28 学时,仪器分析 44 学时 课程性质:药学、中药学各专业本科的必修课 教材选用:李发美主编《分析化学》(第六版),人民卫生出版社 2007 年出版 本校自编《分析化学实验讲义》, 2003 年出版 参考书目:《分析化学学习指导与习题集》(第二版),人民卫生出版社 2008 年出 版 课程章节主要内容及学时分配 章节 讲 课 内 容 学时 一 绪论 1 二 误差与分析数据处理 4 三 滴定分析概论 4 四 酸碱滴定法 6 五 配位滴定法 3 六 氧化还原滴定法 6 七 沉淀滴定法和重量分析法 4 八 电位法和永停滴定法 4 九 光谱分析法概论 2 十 紫外-可见分光光度法 6 十一 荧光分析法 4 十二 红外吸收光谱法 4 十四 核磁共振波谱法 2

质谱法2色谱分析法概论十六4十七气相色谱法高效液相色谱法十八4平面色谱法十九毛细管电泳法十二十一色谱联用分析方法1总计72第一章绪论(1学时)【教学目的及要求】了解分析化学及其性质和任务、发展趋势以及在各领域尤其是药学中的作用;分析方法的分类及分析过程和步骤。【教学内容]1.分析化学的任务和作用;2.分析化学的发展;3.分析化学的方法分类;4.分析过程和步骤;5.分析化学的学习方法。【教学重点难点]1.把分析化学和专业紧密联系起来,激发学生对学科的兴趣。2.分析化学的分类、发展和文献。【教学方法]理论讲授CAI课件[授课时数]1学时[思考题]1.学习分析化学课程的意义
十五 质谱法 2 十六 色谱分析法概论 4 十七 气相色谱法 4 十八 高效液相色谱法 4 十九 平面色谱法 4 二十 毛细管电泳法 3 二十一 色谱联用分析方法 1 总计 72 第一章 绪论 (1 学时) [教学目的及要求] 了解分析化学及其性质和任务、发展趋势以及在各领域尤其是药学中的作 用;分析方法的分类及分析过程和步骤。 [教学内容] 1.分析化学的任务和作用; 2.分析化学的发展; 3.分析化学的方法分类; 4.分析过程和步骤; 5.分析化学的学习方法。 [教学重点难点] 1. 把分析化学和专业紧密联系起来,激发学生对学科的兴趣。 2. 分析化学的分类、发展和文献。 [教学方法] 理论讲授 CAI 课件 [授课时数] 1 学时 [思考题] 1.学习分析化学课程的意义

第二章误差和分析数据处理(4学时)[教学目的及要求]掌握准确度与精密度的表示方法及二者之间的关系,误差产生的原因及减免方法,有效数字的表示方法及运算法则;误差传递及其对分析结果的影响。熟悉偶然误差的正态分布和t分布,置信区间的含义及表示方法,显著性检验的目的和方法,可疑数据的取舍方法,分析数据统计处理的基本步骤了解用相关与回归分析处理变量间的关系。【教学内容]:与误差有关的基本概念2.误差的传递和提高分析结果准确度的方法;3.有效数字及其运算法则,基本统计概念;4.相关与回归。【教学重点难点】1.准确度和精密度、系统误差和偶然误差的概念和表示方法;提高分析结果准确度的方法;有效数字处理方法。2.统计学部分知识,相关与回归。[教学方法]理论讲授 CAI 课件[授课时数]4学时[思考题]1.什么叫有效数字?它的运算规则在实际分析工作中有何作用?2.说明误差与偏差、准确度与精密度的区别和联系?3.如何衡量分析方法的准确性?提高分析结果准确度的方法有哪些?第三章滴定分析法概论(4学时)
第二章 误差和分析数据处理(4 学时) [教学目的及要求] 掌握准确度与精密度的表示方法及二者之间的关系,误差产生的原因及减免 方法,有效数字的表示方法及运算法则;误差传递及其对分析结果的影响。 熟悉偶然误差的正态分布和 t 分布,置信区间的含义及表示方法,显著性检 验的目的和方法,可疑数据的取舍方法,分析数据统计处理的基本步骤。 了解用相关与回归分析处理变量间的关系。 [教学内容] 1.与误差有关的基本概念; 2.误差的传递和提高分析结果准确度的方法; 3.有效数字及其运算法则,基本统计概念; 4.相关与回归。 [教学重点难点] 1. 准确度和精密度、系统误差和偶然误差的概念和表示方法;提高分析结果准 确度的方法;有效数字处理方法。 2. 统计学部分知识,相关与回归。 [教学方法] 理论讲授 CAI 课件 [授课时数] 4 学时 [思考题] 1.什么叫有效数字?它的运算规则在实际分析工作中有何作用? 2.说明误差与偏差、准确度与精密度的区别和联系? 3.如何衡量分析方法的准确性?提高分析结果准确度的方法有哪些? 第三章 滴定分析法概论(4 学时)

【教学目的及要求]掌握滴定反应必须具备的条件;选择指示剂的一般原则:标准溶液及其浓度表示方法:滴定分析法中的有关计算,包括标准溶液浓度的计算、物质的量浓度和滴定度的换算、试样或基准物质称取量的计算、待测物质质量和质量分数的计算;水溶液中弱酸(碱)和配合物各型体的分布和分布系数的含义及分布系数的计算;质子平衡的含义及其平衡式的表达熟悉滴定分析中的常用术语:标准溶液,化学计量点,滴定终点,滴定误差及林邦误差公式,滴定突跃,突跃范围,指示剂,指示剂的理论变色点和变色范围:质量平衡和电荷平衡及其平衡式的表达了解滴定分析的一般过程和滴定曲线、一般指示剂的变色原理和指示终点的原理;常用的滴定方式。[教学内容]滴定分析的基本概念和基本计算2.滴定分析的特点,滴定曲线,指示剂,滴定误差和林邦误差计算公式,滴定分析中的化学计量关系,与标准溶液的浓度和滴定度有关的计算,待测物质的质量和质量分数的计算:3.各种滴定方式及其适用条件;4.标准溶液和基准物质;5.水溶液中弱酸(碱)各型体的分布和分布系数:配合物各型体的分布和分布系数。【教学重点难点]1.滴定分析的概念和分类,以及各种滴定的适用范围,滴定分析定量计算。2.滴定曲线和突跃的理解;滴定中的化学平衡(尤其是配位平衡)。[教学方法]理论讲授 CAI 课件[授课时数]4学时[思考题]1.用于滴定分析的化学反应必须符合哪些条件?基准物质必须具备哪些条件?2.什么是滴定曲线?滴定曲线有何特点?3:什么是突跃范围?什么是指示剂变色范围?
[教学目的及要求] 掌握滴定反应必须具备的条件;选择指示剂的一般原则;标准溶液及其浓度 表示方法;滴定分析法中的有关计算,包括标准溶液浓度的计算、物质的量浓度 和滴定度的换算、试样或基准物质称取量的计算、待测物质质量和质量分数的计 算;水溶液中弱酸(碱)和配合物各型体的分布和分布系数的含义及分布系数的 计算;质子平衡的含义及其平衡式的表达。 熟悉滴定分析中的常用术语:标准溶液,化学计量点,滴定终点,滴定误差 及林邦误差公式,滴定突跃,突跃范围,指示剂,指示剂的理论变色点和变色范 围;质量平衡和电荷平衡及其平衡式的表达。 了解滴定分析的一般过程和滴定曲线、一般指示剂的变色原理和指示终点的 原理;常用的滴定方式。 [教学内容] 1.滴定分析的基本概念和基本计算; 2.滴定分析的特点,滴定曲线,指示剂,滴定误差和林邦误差计算公式,滴定 分析中的化学计量关系,与标准溶液的浓度和滴定度有关的计算,待测物质 的质量和质量分数的计算; 3.各种滴定方式及其适用条件; 4.标准溶液和基准物质; 5.水溶液中弱酸(碱)各型体的分布和分布系数;配合物各型体的分布和分布 系数。 [教学重点难点] 1. 滴定分析的概念和分类,以及各种滴定的适用范围,滴定分析定量计算。 2. 滴定曲线和突跃的理解;滴定中的化学平衡(尤其是配位平衡)。 [教学方法] 理论讲授 CAI 课件 [授课时数] 4 学时 [思考题] 1.用于滴定分析的化学反应必须符合哪些条件?基准物质必须具备哪些条件? 2.什么是滴定曲线?滴定曲线有何特点? 3.什么是突跃范围?什么是指示剂变色范围?

第四章酸碱滴定法(6学时)【教学目的及要求]掌握酸碱指示剂的变色原理、变色范围、影响因素;各种类型酸碱滴定过程中尤其是化学计量点pH的计算,滴定突跃范围,并据此选择恰当的指示剂;各种类型酸、碱能否被准确滴定,多元酸、碱能否分步滴定的判断条件;酸碱滴定分析结果的有关计算和滴定误差的计算;溶剂的酸碱性对溶质酸碱强度的影响,溶剂的均化效应和区分效应,非水酸碱滴定中溶剂的选择,非水溶液中碱的滴定。熟悉影响各类型滴定曲线的因素;几种常用指示剂的变色范围及终点变化情况。非水溶剂的离解性和极性(介电常数)及其对溶质的影响,非水酸碱滴定常用的标准溶液、基准物质和指示剂了解酸碱标准溶液的配制与标定;非水滴定法的特点,非水溶剂的分类,非水溶液中酸的滴定。[教学内容]6.各种酸碱溶液pH值的计算;7.酸碱指示剂的变色原理和变色范围及其影响因素,常用酸碱指示剂及混合指示剂;8.强酸(碱)、一元弱酸(碱)、多元酸(碱)的滴定曲线特征,影响其滴定突跃范围的因素及指示剂的选择;一元弱酸(碱)、多元酸(碱)准确滴定可行性的判断;强酸(碱)、一元弱酸(碱)滴定终点误差的计算;9.酸碱标准溶液的配制与标定10.非水溶液中酸碱滴定法基本原理:溶剂的分类,溶剂的性质,溶剂的选择;非水溶液中酸的滴定和碱的滴定。【教学重点难点]1.酸碱滴定法的基本原理;指示剂的变色原理;常见酸碱滴定标准溶液的配制和标定方法:常见指示剂的变色范围,以及各种滴定的使用条件。2.如何设计实验,进行酸碱滴定,终点误差的计算,应用。[教学方法]理论讲授 CAI 课件[授课时数]6学时[思考题]
第四章 酸碱滴定法(6 学时) [教学目的及要求] 掌握酸碱指示剂的变色原理、变色范围、影响因素;各种类型酸碱滴定过程 中尤其是化学计量点 pH 的计算,滴定突跃范围,并据此选择恰当的指示剂;各 种类型酸、碱能否被准确滴定,多元酸、碱能否分步滴定的判断条件;酸碱滴定 分析结果的有关计算和滴定误差的计算;溶剂的酸碱性对溶质酸碱强度的影响, 溶剂的均化效应和区分效应,非水酸碱滴定中溶剂的选择,非水溶液中碱的滴定。 熟悉影响各类型滴定曲线的因素;几种常用指示剂的变色范围及终点变化情 况。非水溶剂的离解性和极性(介电常数)及其对溶质的影响,非水酸碱滴定常 用的标准溶液、基准物质和指示剂。 了解酸碱标准溶液的配制与标定;非水滴定法的特点,非水溶剂的分类,非 水溶液中酸的滴定。 [教学内容] 6.各种酸碱溶液 pH 值的计算; 7.酸碱指示剂的变色原理和变色范围及其影响因素,常用酸碱指示剂及混合指 示剂; 8.强酸(碱)、一元弱酸(碱)、多元酸(碱)的滴定曲线特征,影响其滴定突 跃范围的因素及指示剂的选择;一元弱酸(碱)、多元酸(碱)准确滴定可行 性的判断;强酸(碱)、一元弱酸(碱)滴定终点误差的计算; 9.酸碱标准溶液的配制与标定; 10. 非水溶液中酸碱滴定法基本原理:溶剂的分类,溶剂的性质,溶剂的选 择;非水溶液中酸的滴定和碱的滴定。 [教学重点难点] 1. 酸碱滴定法的基本原理;指示剂的变色原理;常见酸碱滴定标准溶液的配制 和标定方法;常见指示剂的变色范围,以及各种滴定的使用条件。 2. 如何设计实验,进行酸碱滴定, 终点误差的计算,应用。 [教学方法] 理论讲授 CAI 课件 [授课时数] 6 学时 [思考题]