
咨的分子变为有用和无毒的分子,能否从废物中回收有用的原料。这些问题,有些已得到解决 从整体看来,工作还刚刚开始,还有待继续努力。 生命科学与有机化学密切有关,如果说21世纪是生命科学光辉灿烂的时代,那末化学学科 (包括有机化学)通过与生物学科结合,同样也是光辉灿烂的。由于生命过程是许多生物分子间 发生各种化学反应以及所引起的物质和能最转换的结果,所以可以认为从分子水平认识生命过 强是认识的基础。近年来从分子水平研究生命现象,使生命科学的研究及其应用得到了迅速发 展,化学的理论、观点和方法在整个生命科学中起着不可缺少的作用。过去人们认为研究生命科 学时,化学只是提供合成材料、分离、分析和结构的测定,而生命科学发展到今天,化学还要进 步为其提供理论,观点和方法。即将化学理论和方法移植过来,并用观察生命现象的结果去提高 它们,使之成为生命科学的理论和方法。生命科学正在向化学不断提出质疑和桃战,现有的化学 理论,观点和方法已不敷应用,要注意从生命现象中的分子和原子运动变化规律中总结出新的理 论,再来指导认识生命的科学实践。 有机化学与人类生活关系如此密切,因此也可看到有机化学的任务是艰巨的。, 1.3研究有机化合物的过程 1.提纯 在研究某一种化合物之前,一般要求提纯,因为常常有很多杂质混在一起,必须使用各种方 法将这些杂质除去。提纯方法很多,现在只把最常用最有教的方法加以简单地介绍。 (1)结品:很多有机物是固体,具有一定的结晶形状,如有杂质,可以利用它和杂质在某 剂内的溶解度不同,进行提纯,如果选择不出一种适当的溶剂,可用混合溶剂进行结晶,当然混 合溶剂必须彼此混溶。纯有机物的熔点往往在一度或两度区间之内。 (2)蒸馏:纯有机物有恒定的沸点,因此,可通过蒸馏和分馏的方法来提纯。蒸馏就是把 种物质变为蒸气,然后把蒸气移到别处,使它冷凝再变为液体或固体。如果被蒸馏的物质在沸腾 时是相当稳定的,可以在常压下进行蒸馏;如果在沸腾时会分解成其它物质,则进行减压蒸馏。蒸 馏与减压蒸馏不仅可以把不挥发的杂质分离出去,也可以将不同沸点的挥发性混合物分开。若 混合物各组分沸点比较接近,用蒸馏法很难提纯,这时必须使用分馏柱。应用分馏柱来使几种沸 点相近的混合物进行分离的方法,称为分馏。 (3)升华:某些固体物质不经过熔化,而直接变为蒸气,冷凝又变为固体,这个过程称升华。 当一个固体物质很难溶于任何溶剂或不能用结晶的方法提纯时,有时可以采用升华的方法。升 华地可以在减压下进行。 (④)抽提及层析法:抽提也是提纯有机物常用的一种方法,当一个物质分配在两种彼此不 能混溶的溶剂中,在每一溶剂中所含的物质取决于这个物质在这两种溶剂中的分配率(或称分配 系数)。假若分配系数等于1,就意味着这个物质在这两种溶剂中的含量是相等的,此时就无法用 简单的抽提方法把一个物质从一种溶剂抽提到另一溶剂中。同样,如凡个物质在某种溶剂体系 中分配系效差别不大,也就比较难以把它们一一分开。实验室中常用的分液漏斗(图1-1)是原 3

始的但还是常用的一种重要由提仪器,这种仪器的触点是需要较大量的原料,此外,分配效率也 不高。现在根据这个基本原理,设计出各种层折方法,把分离提纯的手段发展到一个很高的水 平,可以把微克数量级的物质迅速地一一分开,并且加以鉴别,这是分离提纯方法上的一次革命。 假若没有这种方法的发现,稀有的体内物质的研究决不会取得今天的成就,所以一门科学的发展 往往是某一方法的发现起着特别重要的作用。 图1-】分液漏斗图1-2色谱柱装置 图13气相色意示谱图 层析法的西文名称应译为色层分析法,因为最早是在分离植物色素的工作中发现这个方法 的。茨维特(Tsv©t,M.S.)利用吸附剂对某些结构相似的色素的吸附能力不同,把它们一一分 开。常用的吸附剂是特制的硅胶、氧化铝等。如将吸附剂装在一个玻璃管内(称固定相),如图 1-2,然后把要进行分离的有机色素的溶液慢慢地滴人这个管子内,再用一个适当的溶剂(称流动 相,层析中将流动的溶剂称为层析剂或展开剂)冲洗(或称洗脱),由于吸附能力不同,最难吸附的 色素在管内最下部或甚至完全不被吸附而流出管外。各种不同的有色物质经过冲洗后,即形成 一个有几个色带的柱子(因此这种分离法又称为柱色层分析),把这些色带一一分开,再用适当的 溶剂,把被吸附的物质从吸附剂上抽提下来,往往可得到纯的物质或部分分离的物质。后来这种 方法用适当的检测方法(如薄板层析)配合,可用于无色化合物的分离,是目前实验室中普遍使用 的有效的提纯分离方法。现在层析已成为一门学科,发展出各种方法,下面仅就最重要的简略讨 论一下。 气相层折(气相色谱):这一方法是利用物质在气相和液相之间的不同分配。如把几毫升气 体或少量可以挥发的液体注入一个装满了涂有一层不挥发油液膜的担体的柱内(图1-3),将这个 柱子保持一定的温度,同时压人一种惰性气体(通常是氮或氢),让液体样品汽化,挥发的样品和情 性气体混合在一起通过这个长柱时,即进行气液分配,因此尽管样品中各组分的分配系数差别 不大,但是通过多次分配也可以把它们分离开。出来的气体通过检测器将其转化为电讯号在纪录 仪上记录下来,并自动画出一个由多种物质组成的图谱(图1-4),在图中A是一个假峰,由于注射 栉品时带入一点空气而给出的信号,B,C,F是对称的单蜂,相当于完全分离的组分,G,H,I和D
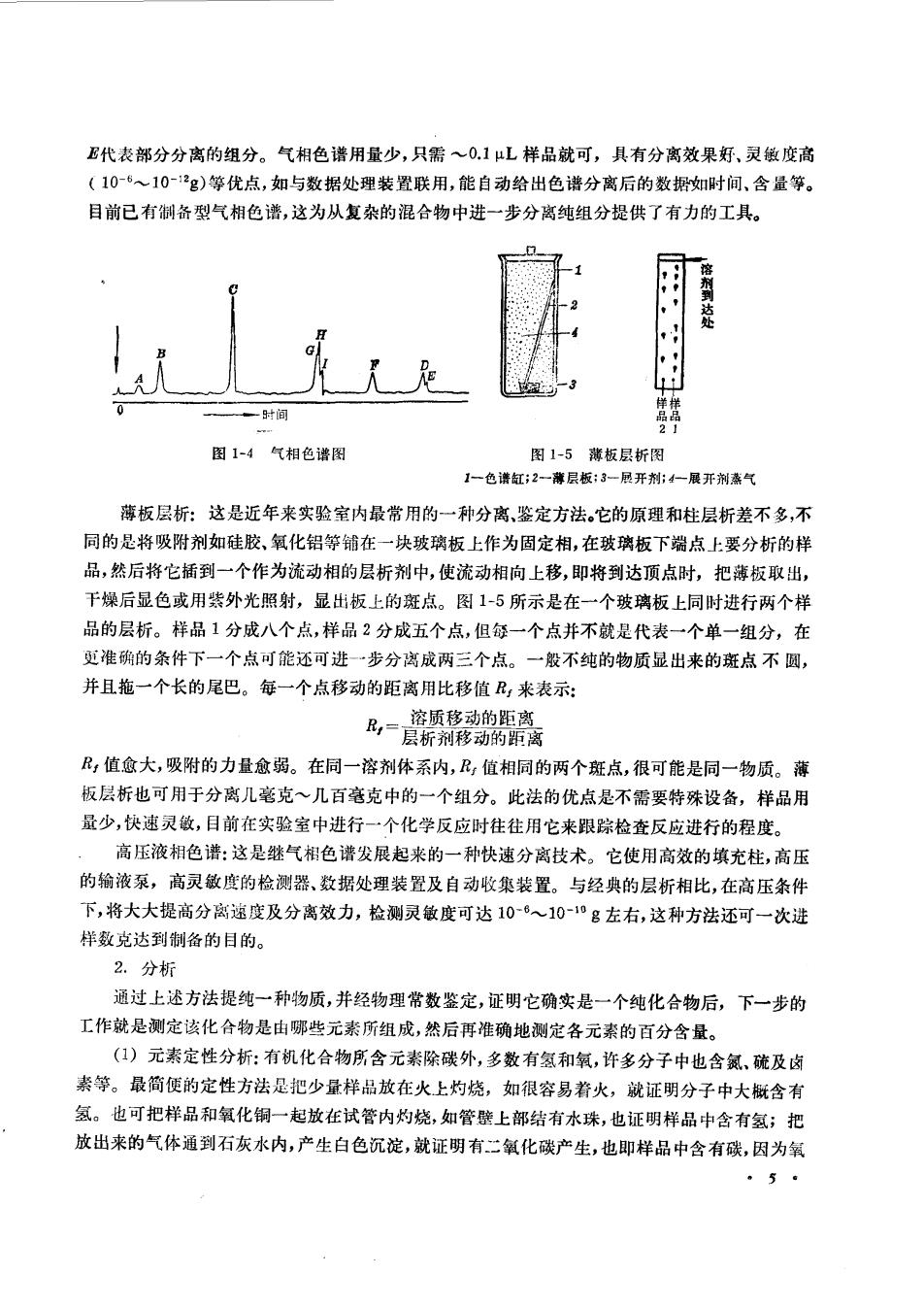
E代表部分分离的组分。气相色谱用量少,只需~01L样品就可,具有分离效果好、灵傲度高 (105~10-g)等优点,如与数据处理装置联用,能自动给出色谱分离后的数据如时间、含量等。 目前已有制备型气相色谱,这为从复杂的混合物中进一步分离纯组分提供了有力的工具。 剂勇达处 一时间 图1-4气相色谱图 图1-5谦板层析图 1色谱缸:2一薄层板:3一展开利:4一展开州蒸气 薄板层析:这是近年来实验室内最常用的一种分离,鉴定方法。它的原理和柱层析差不多,不 同的是将吸附剂如硅胶,氧化铝等铺在一块玻璃板上作为固定相,在玻璃板下端点上要分析的样 品,然后将它插到一个作为流动相的层析剂中,使流动相向上移,即将到达顶点时,把薄板取出, 干燥后显色或用紫外光照射,显出板上的斑点。图1-5所示是在一个玻璃板上同时进行两个样 品的层析。样品1分成八个点,样品2分成五个点,但每一个点并不就是代表一个单一组分,在 更准确的条件下一个点可能还可进一步分离成两三个点。一般不纯的物质显出来的斑点不圆, 并且拖一个长的尾巴。每一个点移动的距离用比移值R,来表示: ,值愈大,吸附的力量愈弱。在同一溶剂体系内,R,值相同的两个斑点,很可能是同一物质。薄 板层析也可用于分离儿毫克~几百毫克中的一个组分。此法的优点是不需要特殊设备,样品用 量少,快速灵敏,目前在实验室中进行一个化学反应时往往用它来跟踪检查反应进行的程度。 高压液相色谱:这是继气相色谱发展起来的一种快速分离技术。它使用高效的填充柱,高压 的输液系,高灵敏度的检测器、数据处理装置及自动收集装置。与经典的层析相比,在高压条件 下,将大大提高分离逸度及分离效力,检测灵敏度可达106~10-°g左右,这种方法还可一次进 样数克达到制备的目的。 2.分析 通过上述方法提纯一种物质,并经物理常数鉴定,证明它确实是一个纯化合物后,下一步的 工作就是测定该化合物是由哪些元素所组成,然后再准确地测定各元素的百分含量。 (1)元素定性分析:有机化合物房含元素除碳外,多数有氢和氧,许多分子中也含氯硫及肉 素等。最简便的定性方法是把少量样品放在火上灼烧,如很容易着火,就证明分子中大概含有 氢。也可把样品和氧化铜一起放在试管内灼烧,如管壁上部结有水珠,也证明样品中含有氢;把 放出来的气体通到石灰水内,产生白色沉淀,就证明有二氧化碳产生,也即样品中含有碳,因为氧 5

化钢能把有机物中的碳和氢氧化成二氧化碳和水。 除谈、氛,氧外,其它常见的元素一般可以用钠挖法测定。把少量的样品加金属钠熔醺,如有 纸、卤素、硫等元素,就分别变为氰化钠、卤化钠和硫化钠。然后用无机定性法测定。譬如在熔融 后浸出的浓液内加几滴醋酸铅,如生成黑色的硫化铅沉淀,就证明样品内含有硫, 在实验室里,通常用简便的贝尔斯坦(Beilstein,F.)法测定卤素。把一根纯铜丝放在无黄光 的火焰上烧红,然后把要分析的化合物少许粘在热的铜丝上,再在火焰上灼烧,假若有卤素存在, 即发生绿色的火焰,这是由于形成了具有挥发性的卤化铜的缘故。 有机化合物中是否含有氧,现无简便的方法测定,通常是在定量分析元素时确定。若样品中 含有其它元素的百分数的总和等于100,则表明该化合物中不含氧;若小于100,则氧的百分数就 等于100减去其它所有元素的百分数的总和。 现在经常用红外光谱(参看第八章),核磁共振谱(参看第八章)、紫外光谱(参看第十一章)中 吸收蜂位置以及质谱(参看第十一章)中的同位素峰、片峰等间接地证明该化合物中某种元素 的存在。 在确定一个样品是由什么元素组成以后,就需要准确地测定元素的百分比,通常测定的元 素是碳,气和氯。 (2)碳和氢的定量分析:有机化合物中碳和氢的定量分析是按李比息(Liebig,J.von,1831) 的方法进行的。准确的碳氢分析是有机化学史上的一个重要事件,对有机化学的发展起着不可 估最的作用。此法的原理是将谁确称量的样品放在一根燃烧管里,用红热的氧化铜氧化,然后再 将有机化合物经彻底“燃烧”后生成的二氧化碳及水,用纯的氧气流分别赶到烧碱石棉剂 (ascarite,附在石棉上粉醉的氢氧化钠)及高氯酸镁的吸收管内,前者将排出的二氧化碳变为碳 酸钠,后者将水吸收变为含有结品水的高氯酸镁,这两个吸收管所增加的质量分别表示生成的二 氧化碳和水的质量,由这些数据即可计算分子中碳和氢的含量,因此碳氢分析是用同-一样品进 行的。 燃烧炉 高氯酸— 图1-6定量分析碳氢的仅器装置示意图 燃烧管是由一个硬质的玻璃管制成的,装入粒状氧化铜,达到如图1-6所示的位置,把氧化 铜填紧。管子的左端装人一个盛有经过准确称量的样品的白金小舟皿,把管子的一端和吸收管连 好,另一端和氧气瓶相连,装有氧化铜的一段管子放置在燃烧炉内。先把氧化铜烧至红热,同时 通人氧气。然后再把舟皿中的样品徐徐加热,舟皿中的有机物受热后或者分解或者汽化,遇到红 热的氧化铜即被氧化成水及二氧化碳,被氧气流排至吸收管中。等吸收完毕后,再称吸妆管的质 6

量,即分别得到二氧化碳和水的质量。若样品中除含碳、氢、氧外还含有其它的元素,仪器的装置 需稍加改变,即可不影响碳氢分析的结果。如样品中含氮,会产生氧化氯,被吸收在烧碱内,因 此就会影响分析的结果,在这种情形下,可在燃烧管内放入一个铜丝的卷子,铜可把氧化氨还原 成氮,这样就不影响分析的结果。分析的谁确度的界限一般为土02%。 有机物经燃烧后,碳和氢的百分含量可按照下式计算: 碳在原样品中的百分数=12×100×称得二氧化碳的质量 44×取样的质量 氢的百分数21的质量 习题1-12.4mgCH0按上述定量分析应产生多少C02及H,0。 (3)氯的定量分析:氨的定量分析是按照杜马(Dumas,J,B.A.,1830)的方法进行的。分 析的原理和碳,氢的测定相同,也是把有机物彻底“燃烧”,氮变为氛气,用二氧化碳气流把它排到 一个装满了浓氢氧化钾溶液的带有刻度的管子内,即所谓的量氯计(图1-7)内。二氧化碳被氢 氧化钾吸收后,所余气体的体积即为氨气的体积,然后计算样品中的含氮量。 按燃烧管 — 拉状氧化铜丝 图1-7最氮计 图1-&定氮时所用的燃烧管 定氮时所用的燃烧管内填充氧化铜与金属铜(图1-8),前者为氧化剂,后者为还原剂。在 分解反应进行过程中,样品中的氮除了变成氮气外,还有一部分生成氮的氧化物,被金属铜还原 为氨气。在称好的样品上覆盖一层氧化铜粉未,放在燃烧管中。管的右端和量氨计相连,左端和 二氧化碳发生器相连。先用二氧化碳气流将燃烧管中的空气彻底排出,然后把量氮计的上部旋塞 打开,将梨形瓶提高,使最氮计装满氢氧化钾溶液,然后关上旋塞,降低梨形瓶。先将粒状氧化铜 烧到红热,再把样品和氧化铜粉末烧热。燃烧后所产生的氨气收集在量氮计内。在“燃烧”中所生 成的氧化氯被红热的铜还原成氮气。最后通人二氧化碳气流将残留在管中的氮气一并赶到量氮 计内。由氮气的体积,就可计算样品中含氮的百分率。 习题1-22.5mgC,HN经燃烧定最分析后,计算产生的C0,H,0及N,的质最。 现在分析C,H,N,O,S的含量,除称量样品用人工操作外,其它一切均自动给出元素的百 分含量。C,H,N分析可用同一样品进行。 97