
2、国际上GMP的发展与实施 GMP产生的历史背景 是社会发展中医药实践经验教训的总结和人类智慧的结晶。是一套 系统的、科学的管理制度。源于美国,十多次较大的药物灾难,反应停 事件促进了它的诞生。副作用:畸形胎儿12000余例,多发性神经炎。 原因:未经过严格的临床前药理实验。1962年,由FDA组织编写, 1963年首次发布。 美国GMP简介: 1963年,美国国会第一次颁布GMP法令。此后,多次修订,成为 美国药事法规体系的一个重要组成部分。1972年,规定:向美国输出 的药品生产企业及在美国境内生产药品的外商都要向FDA注册,符合美 国GMP。1976年,对GMP又进行修订,作为美国法律推行实施。1979 年,修订并增加可包括验证在内的一些新概念及要求
2、国际上GMP的发展与实施 • GMP产生的历史背景 是社会发展中医药实践经验教训的总结和人类智慧的结晶。是一套 系统的、科学的管理制度。源于美国,十多次较大的药物灾难,反应停 事件促进了它的诞生。副作用:畸形胎儿12000余例,多发性神经炎。 原因:未经过严格的临床前药理实验。1962年,由FDA组织编写, 1963年首次发布。 • 美国GMP简介: 1963年,美国国会第一次颁布GMP法令。此后,多次修订,成为 美国药事法规体系的一个重要组成部分。1972年,规定:向美国输出 的药品生产企业及在美国境内生产药品的外商都要向FDA注册,符合美 国GMP。1976年,对GMP又进行修订,作为美国法律推行实施。1979 年,修订并增加可包括验证在内的一些新概念及要求

美国实施现行GMP是FDA在2004年颁布的最新版本。 CGMP指导文件:以行业指南的形式不断增补起草和修订不同类型 医药产品的GMP规范和具体GMP操作的行业规范的文件。 ·WHO的GMP简介 1967年出版的国家药典附录将GMP收载其中;1969年,22届世界 卫生大会建议成员国的药品生产采用GMP制度;1975年11月,提出 修订的GMP;1977年28届世界卫生组织大会,将GMP确定为WHO的 法规;1986年5月,世界卫生组织大会提供WHO药物政策修订版。20 世纪90年代,WHO多次修订GMP。分别于1992、1996及1997年。 ·其他国家或地区的GMP简介 1973年日本提出,1974年颁布试行,1980年正式实施。欧洲经济 共同体,1989年公布第一版;英国1971年制定第一版
美国实施现行GMP是FDA在2004年颁布的最新版本。 CGMP指导文件:以行业指南的形式不断增补起草和修订不同类型 医药产品的GMP规范和具体GMP操作的行业规范的文件。 • WHO的GMP简介 1967年出版的国家药典附录将GMP收载其中;1969年,22届世界 卫生大会建议成员国的药品生产采用GMP制度;1975年11月,提出 修订的GMP;1977年28届世界卫生组织大会,将GMP确定为WHO的 法规;1986年5月,世界卫生组织大会提供WHO药物政策修订版。20 世纪90年代,WHO多次修订GMP。分别于1992、1996及1997年。 • 其他国家或地区的GMP 简介 1973年日本提出,1974年颁布试行,1980年正式实施。 欧洲经济 共同体,1989年公布第一版;英国1971年制定第一版
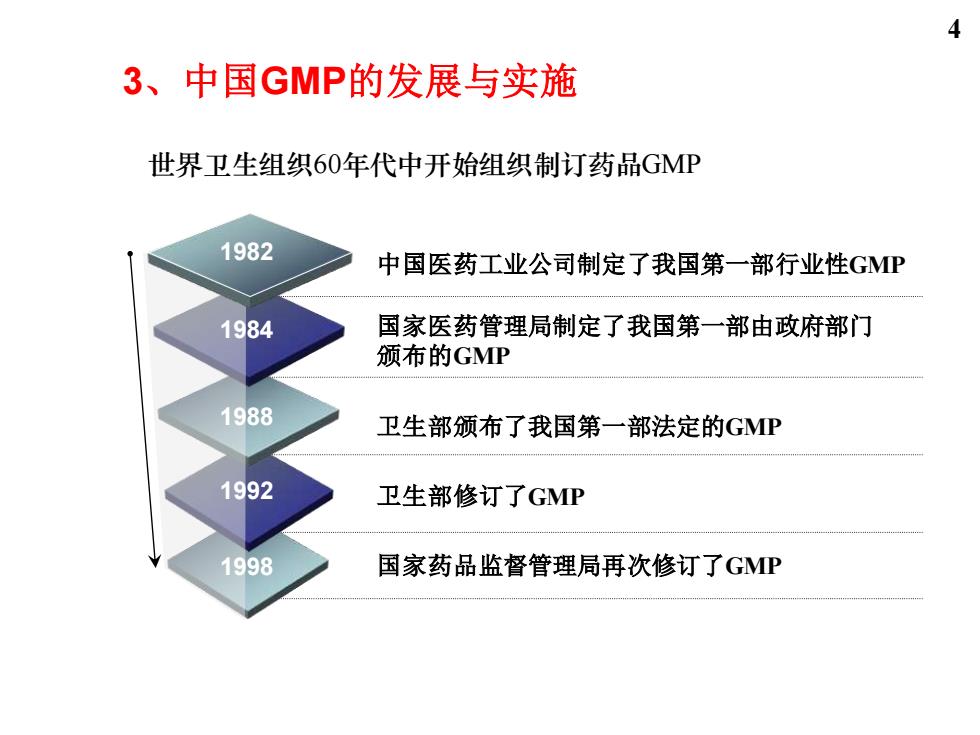
4 3、中国GMP的发展与实施 世界卫生组织60年代中开始组织制订药品GMP 1982 中国医药工业公司制定了我国第一部行业性GMP 1984 国家医药管理局制定了我国第一部由政府部门 颁布的GMP 1988 卫生部颁布了我国第一部法定的GMP 1992 卫生部修订了GMP 1998 国家药品监督管理局再次修订了GMP
1998 1992 1988 1984 1982 中国医药工业公司制定了我国第一部行业性GMP 国家医药管理局制定了我国第一部由政府部门 颁布的GMP 卫生部颁布了我国第一部法定的GMP 卫生部修订了GMP 国家药品监督管理局再次修订了GMP 3、中国GMP的发展与实施 世界卫生组织60年代中开始组织制订药品GMP 4
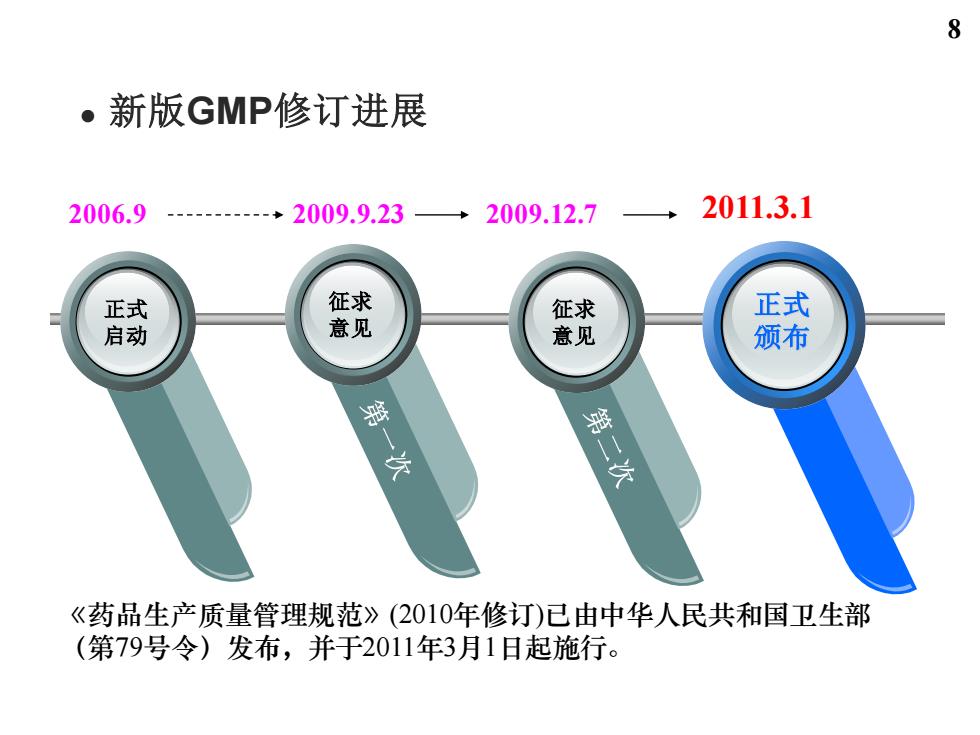
8 。新版GMP修订进展 2006.9 2009.9.23→2009.12.7 →2011.3.1 正式 征求 征求 正式 启动 意见 意见 颁布 溫 方 第二次 《药品生产质量管理规范》(2010年修订)已由中华人民共和国卫生部 (第79号令)发布,并于2011年3月1日起施行
正式 启动 正式 颁布 征求 意见 征求 意见 2006.9 2009.9.23 2009.12.7 2011.3.1 ⚫ 新版GMP修订进展 《药品生产质量管理规范》(2010年修订)已由中华人民共和国卫生部 (第79号令)发布,并于2011年3月1日起施行。 8

42 ·主要修订内容 《药品生产质量管理规范(2010年修订)》共14章、 313条,内容包括基本要求和附录。 其修订包括:加强药品生产质量管理体系建设,大幅 提高对企业质量管理软件方面的要求;全面强化从业人员 的素质要求;细化操作规程、生产记录等文件管理规定, 增强了指导性和可操作性;进一步完善药品安全保障措施
《药品生产质量管理规范(2010年修订)》共14章、 313条,内容包括基本要求和附录。 其修订包括:加强药品生产质量管理体系建设,大幅 提高对企业质量管理软件方面的要求;全面强化从业人员 的素质要求;细化操作规程、生产记录等文件管理规定, 增强了指导性和可操作性;进一步完善药品安全保障措施。 • 主要修订内容 42