
再如,由铁的电势图: 0,VFe0,2-+19fe3++07LFe2t-044Fe0,+1229,0 FeFe(O -0.56.Fe(OH)0.87Pe 02+0.400H 由于pa(O2/H,0)=1.229V>paFe3+/Fe2+)=0.771V p(O2/OH-)=0.40V>p[Fe(OH)3/Fe(OH)2]=-0.56V 因此,Fe(I)能被空气中的氧氧化为Fe(II)是难免的,所以 在实验室保存F2+溶液往往是在强酸性下加入铁屑或铁钉
再如,由铁的电势图: φa θ /V φb θ /V 由于 φa θ(O2 /H2O)=1.229V > φa θ(Fe 3+/Fe 2+)=0.771V φb θ(O2 /OH-)=0.40V> φb θ[Fe(OH) 3 /Fe(OH) 2]=-0.56V 因此,Fe(II)能被空气中的氧氧化为Fe(III)是难免的,所以 在实验室保存Fe 2+溶液往往是在强酸性下加入铁屑或铁钉。 FeO4 2 Fe(OH)3 Fe(OH)2 Fe +0.9 -0.56 -0.877 O2 +1.229 H2O O2 +0.40 OH- FeO4 2 Fe 3+ Fe 2+ Fe +1.9 +0.771 -0.44

二自由能一温度图 1单质的提取 方法 (1)以天然状态存在的单质的物理分离法 如淘金 (2)热分解法 2Hg0△2Hg+02 2Ag20△4Ag+02 (3)热还原法 a以C作还原剂 Zn0+c△,Zn+c0 b用氢作还原剂、 w0,+3H,473Kw+3H,0 c用比较活泼的金属作还原剂 Cr03十2A1→ 2Cr+A1203 TiC14+2Mg→Ti+2MgC12 电解 (4)电解法 NaC1 Na+C12
二 自由能-温度图 1 单质的提取 方法 (1)以天然状态存在的单质的物理分离法 如淘金 (2)热分解法 2HgO 2Hg+O2 2Ag2O 4Ag+O2 (3)热还原法 a 以C作还原剂 ZnO + C Zn+CO b 用氢作还原剂 WO3+3H2 W+3H2O c 用比较活泼的金属作还原剂 Cr2O3+2A1 2Cr+A12O3 TiC14+2Mg Ti+2MgC12 (4)电解法 NaC1 Na+ ½ C12 电解 △ △ △ 1473K

2还原过程的热力学(自由能一温度图) 应用自由能变△G可以判断某一金属从其化合物中还原出 来的难易以及如何选择还原剂等问题。 金属氧化物越稳定,则还原成金属就越困难。各种不同金 属氧化物还原的难易可定量地比较他们的生成自由能来确定。 氧化物的生成自由能越负,则氧化物越稳定,金属亦就越 难被还原。 Ellingham(艾林罕姆)在1944年首先将氧化物的标准生成自 由能(纵坐标)对温度(横坐标)作图(以后又对硫化物、氯化物、 氟化物等作类似的图形),用以帮助人们: ①判断哪种氧化物更稳定 ②比较还原剂的强弱 ③估计还原反应进行的温度条件 ④选择还原方法 这种图现在称为自由能一温度图,或艾林罕姆图。这种图 在治金学上具有特别重要的意义
应用自由能变△Gθ可以判断某一金属从其化合物中还原出 来的难易以及如何选择还原剂等问题。 金属氧化物越稳定,则还原成金属就越困难。各种不同金 属氧化物还原的难易可定量地比较他们的生成自由能来确定。 氧化物的生成自由能越负,则氧化物越稳定,金属亦就越 难被还原。 Ellingham(艾林罕姆)在1944年首先将氧化物的标准生成自 由能(纵坐标)对温度(横坐标)作图(以后又对硫化物、氯化物、 氟化物等作类似的图形),用以帮助人们: ①判断哪种氧化物更稳定 ②比较还原剂的强弱 ③估计还原反应进行的温度条件 ④选择还原方法 2 还原过程的热力学(自由能-温度图) 这种图现在称为自由能-温度图,或艾林罕姆图。这种图 在冶金学上具有特别重要的意义
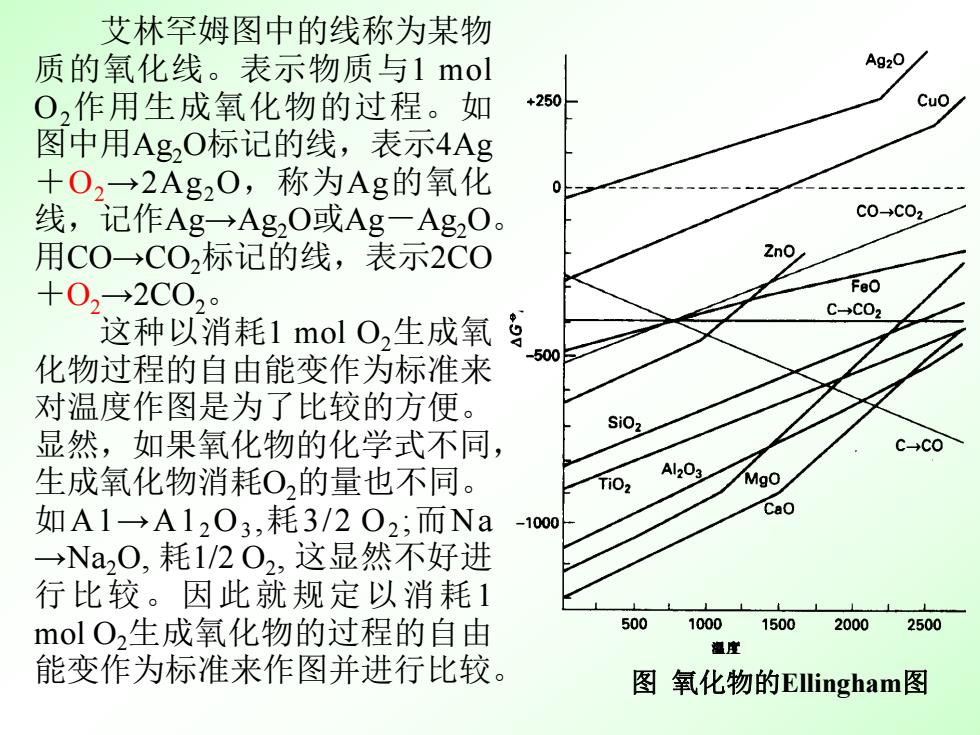
艾林罕姆图中的线称为某物 质的氧化线。表示物质与1mol Ag2O O2作用生成氧化物的过程。如 +250 Cuo 图中用Ag2O标记的线,表示4Ag +O2→2Ag20,称为Ag的氧化 线,记作Ag→Ag2O或Ag-Ag2O。 C0-→c02 用C0-→C02标记的线,表示2C0 +02→2C02 FeO C→C02 这种以消耗1mol0,生成氧 500 化物过程的自由能变作为标准来 对温度作图是为了比较的方便。 SiO2 显然,如果氧化物的化学式不同, c-co 生成氧化物消耗O2的量也不同。 Al203 TiOz Mgo 如A1→A1203,耗3/202;而Na -1000 Cao →Na20,耗1/202,这显然不好进 行比较。因此就规定以消耗1 molO2生成氧化物的过程的自由 500 100015002000 2500 潮崖 能变作为标准来作图并进行比较。 图氧化物的Ellingham图
艾林罕姆图中的线称为某物 质的氧化线。表示物质与1 mol O2作用生成氧化物的过程。如 图中用Ag2O标记的线,表示4Ag +O2→2Ag2O,称为Ag的氧化 线,记作Ag→Ag2O或Ag-Ag2O。 用CO→CO2标记的线,表示2CO +O2→2CO2。 这种以消耗1 mol O2生成氧 化物过程的自由能变作为标准来 对温度作图是为了比较的方便。 显然,如果氧化物的化学式不同, 生成氧化物消耗O2的量也不同。 如A1→A12O3 ,耗3/2 O2 ;而Na →Na2O, 耗1/2 O2 , 这显然不好进 行比较。因此就规定以消耗1 mol O2生成氧化物的过程的自由 能变作为标准来作图并进行比较。 图 氧化物的Ellingham图
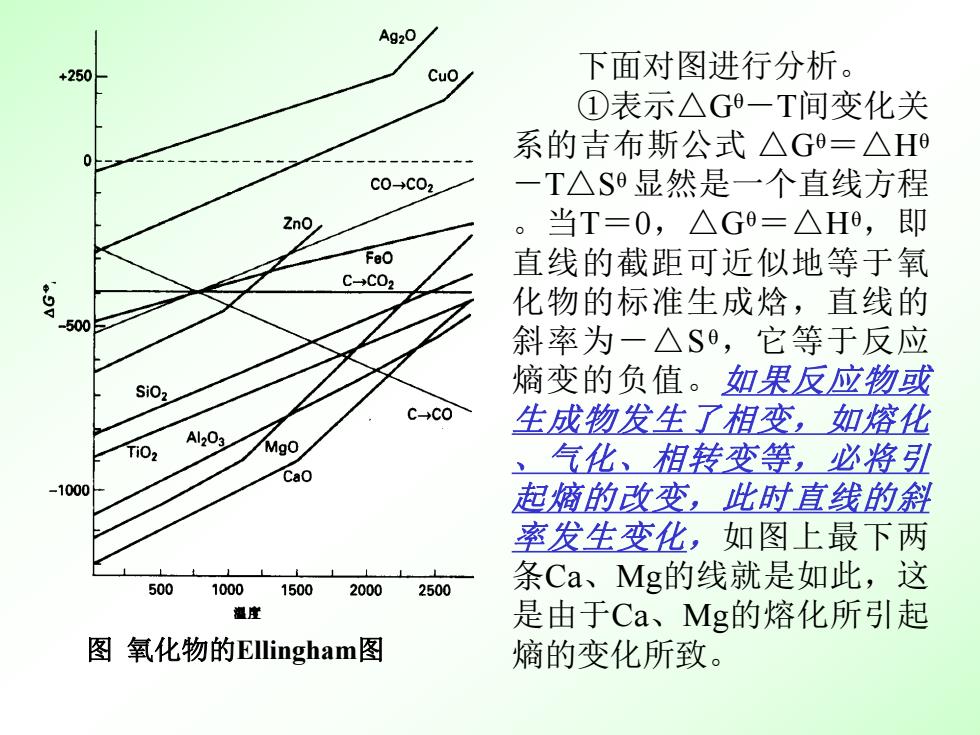
Ag20 +250 Cuo 下面对图进行分析。 ①表示△G一T间变化关 系的吉布斯公式△G=△H c0-→c02 一T△S显然是一个直线方程 2n0 。当T=0,△G=△H0,即 FeO 直线的截距可近似地等于氧 C→C02 化物的标准生成焓,直线的 500 斜率为一△S,它等于反应 SiO2 熵变的负值。如果反应物或 C→C0 生成物发生了相变,如熔化 Al203 Mgo 、 气化、相转变等,必将引 Cao -1000 起熵的改变,此时直线的斜 率发生变化,如图上最下两 500 10001500 2000 2500 条Ca、Mg的线就是如此,这 漫雀 是由于Ca、Mg的熔化所引起 图氧化物的Ellingham图 熵的变化所致
下面对图进行分析。 ①表示△Gθ-T间变化关 系的吉布斯公式 △Gθ=△Hθ -T△Sθ 显然是一个直线方程 。当T=0,△Gθ=△Hθ ,即 直线的截距可近似地等于氧 化物的标准生成焓,直线的 斜率为-△Sθ ,它等于反应 熵变的负值。如果反应物或 生成物发生了相变,如熔化 、气化、相转变等,必将引 起熵的改变,此时直线的斜 率发生变化,如图上最下两 条Ca、Mg的线就是如此,这 是由于Ca、Mg的熔化所引起 图 氧化物的Ellingham图 熵的变化所致