
热力学研究在无机化学 中的应用 一热力学在阐明无机化学问题中的重要性 在我国,北京大学化学系已故的付鹰先生最先将热力学引进 无机化学的教学。在1956一1958年间他在讲普通化学时,自编了 讲义,其中第三章“能与化学变化”和第九章“热化学”都是讲 的化学热力学的基础知识。后来,尹敬执和申泮文教授编的基础 无机化学教材上开始有了化学热力学的初步知识介绍。 随着教材的更新,越来越感到需要运用能量变化的规律来阐 明一些化学现象,用热力学的知识来加深无机化学知识的理解。 运用热力学的知识,除能更好地阐明无机化学的四大平衡及 其联系外,还可以有助于从理论上来定量地讨论化学反应,寻求 影响反应进行的因素和指导进行无机合成。 有时,为了阐明无机物性质及其无机反应的规律,当应用了 热力学的观点时往往比单靠微观结构观点更能得到满意的结果
热力学研究在无机化学 中的应用 一 热力学在阐明无机化学问题中的重要性 在我国,北京大学化学系已故的付鹰先生最先将热力学引进 无机化学的教学。在1956-1958年间他在讲普通化学时,自编了 讲义,其中第三章“能与化学变化”和第九章“热化学”都是讲 的化学热力学的基础知识。后来,尹敬执和申泮文教授编的基础 无机化学教材上开始有了化学热力学的初步知识介绍。 随着教材的更新,越来越感到需要运用能量变化的规律来阐 明一些化学现象,用热力学的知识来加深无机化学知识的理解。 运用热力学的知识,除能更好地阐明无机化学的四大平衡及 其联系外,还可以有助于从理论上来定量地讨论化学反应,寻求 影响反应进行的因素和指导进行无机合成。 有时,为了阐明无机物性质及其无机反应的规律,当应用了 热力学的观点时往往比单靠微观结构观点更能得到满意的结果

例,磷和硅是同一族的两个元素,但是它们的氧化物的性质 相差很大: SiO,原子晶体,mp.1723℃, b.p.2230℃,不溶于水, 溶于HF酸生成SF4; C02分子晶体,mp.-78.4℃,b.p.-56.2℃,溶于水, 不溶于HF。 倘若你仅从原子结构的观点一C、Si的电子结构都是ns2np2 是很难解释它们性质上的差别的,但是从热力学角度出发,通过 比较键能的大小并结合结构理论很好地解释了这个问题。 Si-0 Si=0 C-0 C=0 键能/kJ.mol-1 464 640 360 803 若Si与O生成两条双键,键能1280 kJ.mol-1; 但四条单键1756 kJmol-1。 反过来,C与0生成两条双键,键能1606 kJ.mol-1: 但四条单键1460 kJ.mol-1
例,磷和硅是同一族的两个元素,但是它们的氧化物的性质 相差很大: SiO2 原子晶体, m.p. 1723 ℃, b.p. 2230 ℃,不溶于水, 溶于HF酸生成SiF4; CO2 分子晶体, m.p. -78.4 ℃, b.p. -56.2 ℃,溶于水, 不溶于HF。 倘若你仅从原子结构的观点-C、Si的电子结构都是ns2np2- 是很难解释它们性质上的差别的,但是从热力学角度出发,通过 比较键能的大小并结合结构理论很好地解释了这个问题。 Si-O Si=O C-O C=O 键能/kJ·mol-1 464 640 360 803 若Si与O生成两条双键,键能1280 kJ·mol-1; 但四条单键1756 kJ·mol-1 。 反过来,C与O生成两条双键,键能1606 kJ·mol-1; 但四条单键1460 kJ·mol-1

可见,从能量的观点可以得出结论:硅与氧 所形成的化合物是以Si一O单键为基础的,而C 的化合物则主要是C=O双键,所以CO,和SiO,的 结构不相同。前者是网状大分子,含有SO4四面 体结构单元,其中Si以单键与4个氧连结,氧以 两个S之间的氧桥形式存在,要破坏这种结构需 要很高的能量,所以它的溶、沸点都很高,也不 溶于水,与HF作用是生成了易挥发的SF4。后者 是线性孤立分子,分子间以分子间力联系,所以 它的溶、沸点较低
可见,从能量的观点可以得出结论:硅与氧 所形成的化合物是以Si-O单键为基础的,而C 的化合物则主要是C=O双键,所以CO2和SiO2的 结构不相同。前者是网状大分子,含有SiO4四面 体结构单元,其中Si以单键与4个氧连结,氧以 两个Si之间的氧桥形式存在,要破坏这种结构需 要很高的能量,所以它的溶、沸点都很高,也不 溶于水,与HF作用是生成了易挥发的SiF4。后者 是线性孤立分子,分子间以分子间力联系,所以 它的溶、沸点较低
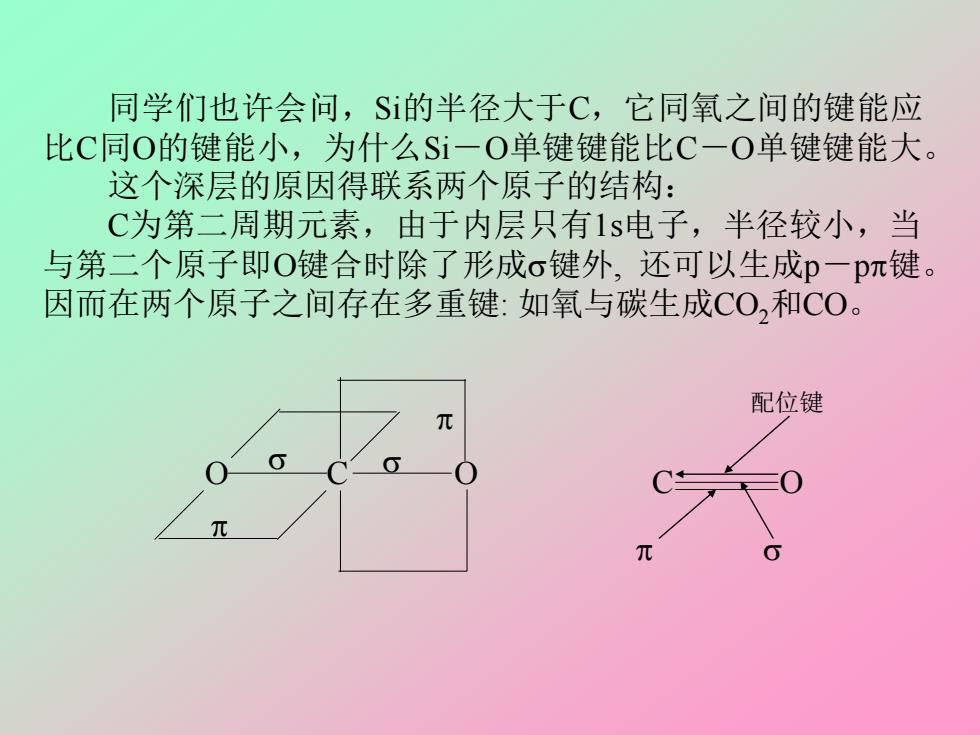
同学们也许会问,S的半径大于C,它同氧之间的键能应 比C同O的键能小,为什么Si一O单键键能比C一O单键键能大。 这个深层的原因得联系两个原子的结构: C为第二周期元素,由于内层只有1s电子,半径较小,当 与第二个原子即O键合时除了形成σ键外,还可以生成p一pπ键。 因而在两个原子之间存在多重键:如氧与碳生成CO,和C0。 配位键
同学们也许会问,Si的半径大于C,它同氧之间的键能应 比C同O的键能小,为什么Si-O单键键能比C-O单键键能大。 这个深层的原因得联系两个原子的结构: C为第二周期元素,由于内层只有1s电子,半径较小,当 与第二个原子即O键合时除了形成键外, 还可以生成p-p键。 因而在两个原子之间存在多重键: 如氧与碳生成CO2和CO。 O C O C O 配位键

而$i是第三周期元素,内层电子较多,半径较大,生成p一 pπ键难度较大,而倾向于以一定杂化态形成尽可能多的单键,因 而常以单键同其它原子结合。 但是这种单键又不同于象C一O中的那种简单的单键,因为 Si有3d空轨道,3d空轨道的能级与3p相差不远,氧上2s22p4的孤 对电子可以反馈到Si的3d轨道上生成反馈的p一dπ键,这样一来 Si与氧之间就形成了一定程度的多重键,p一dπ键的键能比p一p π键的键能要小一些,所以就有了这样的能量次序: C=0 Si=0 Si-0 C-0 o十p一pπ o十p一p元 o+p-dπ 0 803 kJ.mol-l 640 464 360 这样,Si一O单键(实际上是o十p一dπ)的键能比C-O单键 (纯σ)大就不难理解了
而Si是第三周期元素,内层电子较多,半径较大,生成p- p键难度较大,而倾向于以一定杂化态形成尽可能多的单键,因 而常以单键同其它原子结合。 但是这种单键又不同于象C-O中的那种简单的单键,因为 Si有3d空轨道,3d空轨道的能级与3p相差不远,氧上2s 22p 4的孤 对电子可以反馈到Si的3d轨道上生成反馈的p-d键,这样一来 Si与氧之间就形成了一定程度的多重键,p-d键的键能比p-p 键的键能要小一些,所以就有了这样的能量次序: C=O Si=O Si-O C-O +p-p +p-p +p-d 803 kJ·mol-1 640 464 360 这样,Si-O单键(实际上是+p-d)的键能比C-O单键 (纯)大就不难理解了