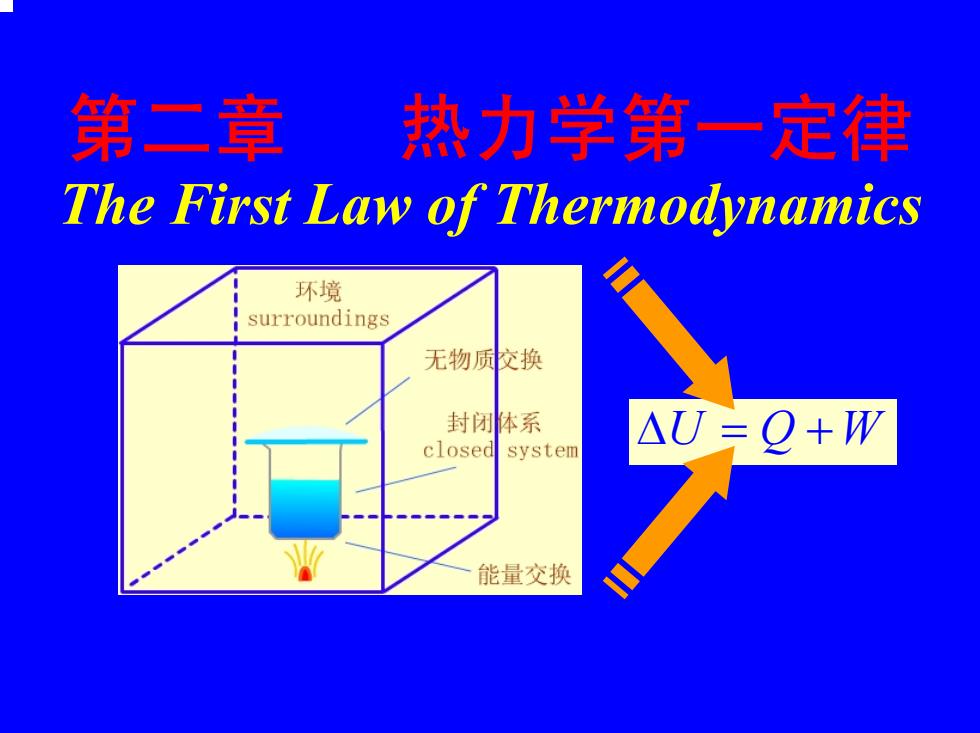
第二章 热力学第一定律 The First Law of Thermodynamics 环境 surroundings 无物质校换 封闭体系 △U三Q+W closed system 能量交换
第二章 热力学第一定律 The First Law of Thermodynamics ∆U Q= +W ∆ = U Q +W

2.0 引言 2.0.1 热力学thermodynamics的目的和内容 1850年左右 焦耳Joule 热力学第一定律 1848年 开尔文Kelvin 和1850年 克劳修斯Clausius 热力学第二定律 •本世纪初 热力学第三定律 化学热力学chemical thermodynamics
2.0 引言 2.0.1 热力学thermodynamics的目的和内容 •1850年左右 焦耳Joule 热力学第一定律 •1848年 开尔文Kelvin 和1850年 克劳修斯Clausius 热力学第二定律 •本世纪初 热力学第三定律 化学热力学chemical thermodynamics

热力学的研究对象 •研究热、功和其他形式能量之间的相互 转换及其转换过程中所遵循的规律; •研究各种物理变化和化学变化过程中所 发生的能量效应; 研究化学变化的方向和限度
热力学的研究对象 •研究热、功和其他形式能量之间的相互 转换及其转换过程中所遵循的规律; •研究各种物理变化和化学变化过程中所 发生的能量效应; •研究化学变化的方向和限度

2.0.2热力学的方法和局限性 热力学方法 研究对象是大数量分子的集合体,研究 宏观性质,所得结论具有统计意义。 •只考虑变化前后的净结果,不考虑物质 的微观结构和反应机理。 ·能判断变化能否发生以及进行到什么程 度,但不考虑变化所需要的时间。 局限性 不知道反应的机理、速率和微观性 质,只讲可能性,不讲现实性
2.0.2 热力学的方法和局限性 热力学方法 •研究对象是大数量分子的集合体,研究 宏观性质,所得结论具有统计意义。 •只考虑变化前后的净结果,不考虑物质 的微观结构和反应机理。 •能判断变化能否发生以及进行到什么程 度,但不考虑变化所需要的时间。 局限性 不知道反应的机理、速率和微观性 质,只讲可能性,不讲现实性
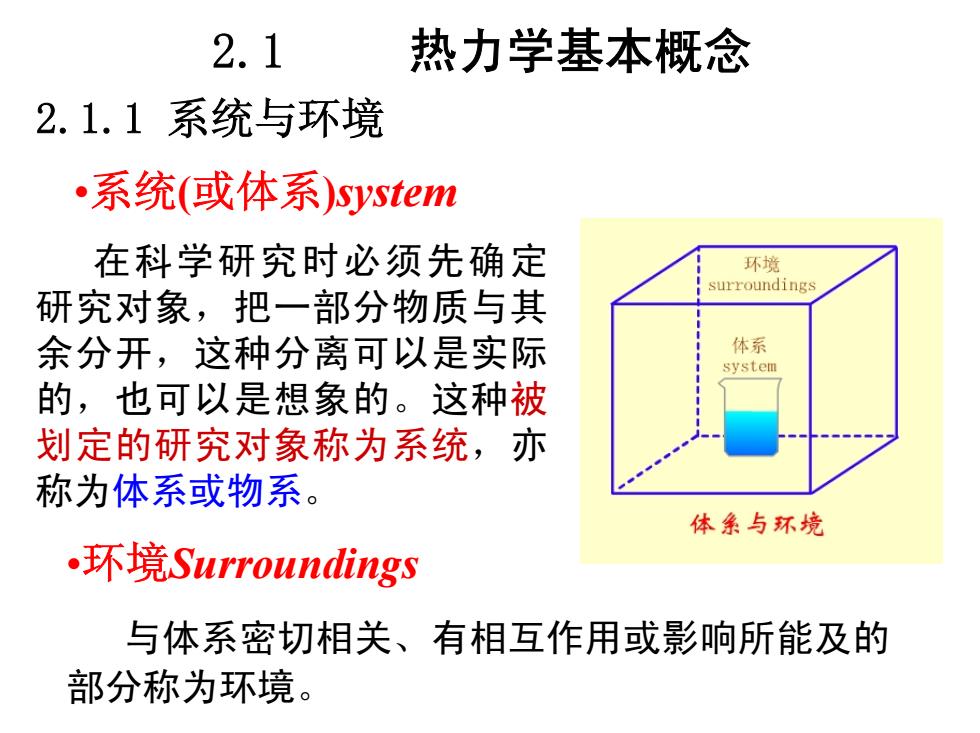
2.1 热力学基本概念 2.1.1系统与环境 系统(或体系)system 在科学研究时必须先确定 环境 surroundings 研究对象,把一部分物质与其 余分开,这种分离可以是实际 体系 system 的,也可以是想象的。这种被 划定的研究对象称为系统,亦 称为体系或物系。 体条与环境 ,环境Surroundings 与体系密切相关、有相互作用或影响所能及的 部分称为环境
2.1 热力学基本概念 2.1.1 系统与环境 •系统(或体系)system 在科学研究时必须先确定 研究对象,把一部分物质与其 余分开,这种分离可以是实际 的,也可以是想象的。这种被 划定的研究对象称为系统,亦 称为体系或物系。 •环境Surroundings 与体系密切相关、有相互作用或影响所能及的 部分称为环境