
第四章 化 学 动 力 学
第四章 化 学 动 力 学

§1 化学动力学的任务与概况 一、化学动力学的任务 化学热力学研究(战略问题——可能性): 化学反应自动进行的方向、限度及平衡条件。 化学动力学研究(战术问题——可行性) : 化学反应进行的速率、机理和影响速率的因素。 H2 (g) + 0.5O2 (g) ==== H2O(l) 1 r m,1 (298.15K) 237.19kJ mol − G = − 2NO2 (g) ==== N2O4 (g) 1 r m,2 (298.15K) 5.39kJ mol − G = −
§1 化学动力学的任务与概况 一、化学动力学的任务 化学热力学研究(战略问题——可能性): 化学反应自动进行的方向、限度及平衡条件。 化学动力学研究(战术问题——可行性) : 化学反应进行的速率、机理和影响速率的因素。 H2 (g) + 0.5O2 (g) ==== H2O(l) 1 r m,1 (298.15K) 237.19kJ mol − G = − 2NO2 (g) ==== N2O4 (g) 1 r m,2 (298.15K) 5.39kJ mol − G = −

当 r GT , p <0时,动力学研究有意义。 当 r GT , p >0时,动力学研究无意义。 热力学上得到肯定的反应,通过动力学研究, 寻找提高反应速率的途径。 二、化学动力学的发展概况 质量作用定律 阿仑尼乌斯公式 碰撞 理论 过渡状态理论 分子反应动态学 1.宏观反应动力学:从宏观的角度研究反应的机 理和动力学行为,各种宏观因素对速率的影响
当 r GT , p <0时,动力学研究有意义。 当 r GT , p >0时,动力学研究无意义。 热力学上得到肯定的反应,通过动力学研究, 寻找提高反应速率的途径。 二、化学动力学的发展概况 质量作用定律 阿仑尼乌斯公式 碰撞 理论 过渡状态理论 分子反应动态学 1.宏观反应动力学:从宏观的角度研究反应的机 理和动力学行为,各种宏观因素对速率的影响

2. 元反应动力学:借助统计力学的方法,从微观 分子反应的动力学行为特征出发,研究宏观元反 应动力学。 3. 分子反应动力学:借助量子力学的方法,通过 对分子束散射技术和远红外化学冷光等现象的研 究,探究分子经碰撞发生化学反应的动力学行为 及能量传递和变化等问题。 速率涉及时间: 年 飞秒 飞秒化学 浓度涉及空间:线性 分形 非线性
2. 元反应动力学:借助统计力学的方法,从微观 分子反应的动力学行为特征出发,研究宏观元反 应动力学。 3. 分子反应动力学:借助量子力学的方法,通过 对分子束散射技术和远红外化学冷光等现象的研 究,探究分子经碰撞发生化学反应的动力学行为 及能量传递和变化等问题。 速率涉及时间: 年 飞秒 飞秒化学 浓度涉及空间:线性 分形 非线性
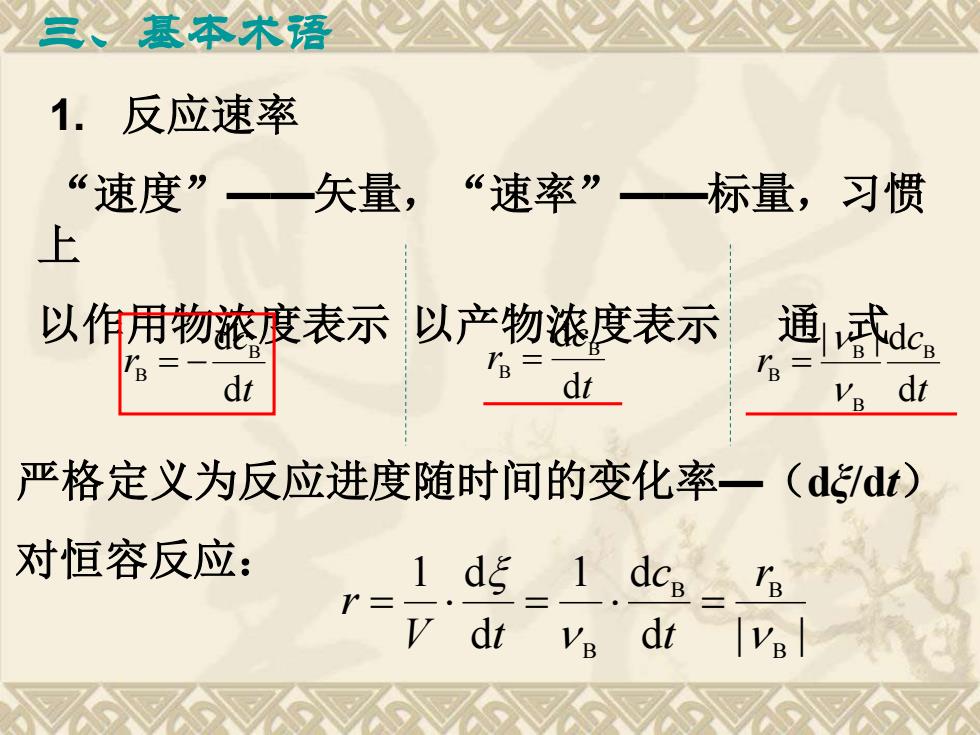
三、基本术语 1. 反应速率 “速度”——矢量,“速率”——标量,习惯 上 以作用物浓度表示 以产物浓度表示 通 式 t c r d d B B = − t c r d d B B = t c r d | | d B B B B = 严格定义为反应进度随时间的变化率—(dξ/dt) 对恒容反应: d | | 1 d d 1 d B B B B r t c V t r = = =
三、基本术语 1. 反应速率 “速度”——矢量,“速率”——标量,习惯 上 以作用物浓度表示 以产物浓度表示 通 式 t c r d d B B = − t c r d d B B = t c r d | | d B B B B = 严格定义为反应进度随时间的变化率—(dξ/dt) 对恒容反应: d | | 1 d d 1 d B B B B r t c V t r = = =