
2)混合实际气体中组分化学势 纯B:B(T,P)=μB(T)+RTL fB=YBPB 混合物:业B(T,P)=ug9(T)+RTnA fe =YePe 路易斯一伦道尔近似公式:fB=fBxB ∫B:混合实气中,B组分的逸度 fB: 纯态B处于混合实气的T和P下, B组分单独存在时的逸度
1 2)混合实际气体中组分化学势 纯 B:μB (T,P)=μB θ (T)+ RTLn P f B B B PB f = 混合物:μB (T,P)=μB θ (T)+ RTLn P f B B B PB f = 路易斯—伦道尔近似公式: B B B f f x = B f :混合实气中,B 组分的逸度 B f : 纯态 B 处于混合实气的 T 和 P 下, B 组分单独存在时的逸度

X:B组分在混合实气中的摩尔分数 可由相同T,P下纯态B的f与B在 混合实际气体中的摩尔分数,计算混合 实际气体中B在T,P下的逸度fB 虽然近似,适用许多气体 ∫B:B组分在T和混合总压P时的逸度 fB:B组分在T和混合压力P时纯态下的逸度 fB=fBXB=YaPXE≈YBPa 适用:低压 2
2 虽然近似,适用许多气体 f B B P = B f :B 组分在 T 和混合总压 P 时的逸度 B f : B 组分在 T 和混合压力 P 时纯态下的逸度 B B B B PxB B PB f f x = = 适用:低压 XB:B 组分在混合实气中的摩尔分数 可由相同 T,P 下纯态 B 的 B f 与 B 在 混合实际气体中的摩尔分数,计算混合 实际气体中 B 在 T,P 下的逸度 B f

fB计算: a)B组分在混合气总压P,T→兀,日→YB b)fe=J8xB,f8=YBP,fe =Y8PB 例:在400℃,30397KPa下,合成甲醇反应 CO (g)+2H20 (g)-CHOH (g) 已知Tc,Pc,求Yco,YH,0,YcH,oH 由T,P→,兀→YB 说明:适用混合实气总压P<100P=10Pa
3 B f 计算: a)B 组分在混合气总压 P,T→π,θ→γB ° b) , B B B f f x = B B B B PB f P f = , = 例:在 400℃,30397KPa 下,合成甲醇反应 CO(g) + 2H2 O(g)→ CH3 OH(g) 已知 TC ,PC ,求 CO H2 O CH3 O H , , 由 T,P→θ,π→γB 说明:适用混合实气总压 P<100Pθ=104 Pa

§3.2稀溶液中的两个经验定律 1.拉乌尔定律(Raoult) 100℃水,饱和蒸汽压P*=P9=100KPa 加入NaCl,P〈P* 1887年,拉鸟尔提出定量关系: PA=P*XA PA:溶液中溶剂的蒸汽压 P*A:纯溶剂的蒸汽压 X4:溶液中溶剂A的摩尔分数 4
4 §3.2 稀溶液中的两个经验定律 1.拉乌尔定律(Raoult) 100℃水,饱和蒸汽压 P*=Pθ=100KPa 加入 NaCl,P < P* 1887 年,拉乌尔提出定量关系: PA:溶液中溶剂的蒸汽压 P*A:纯溶剂的蒸汽压 XA:溶液中溶剂 A 的摩尔分数 PA =P*AXA
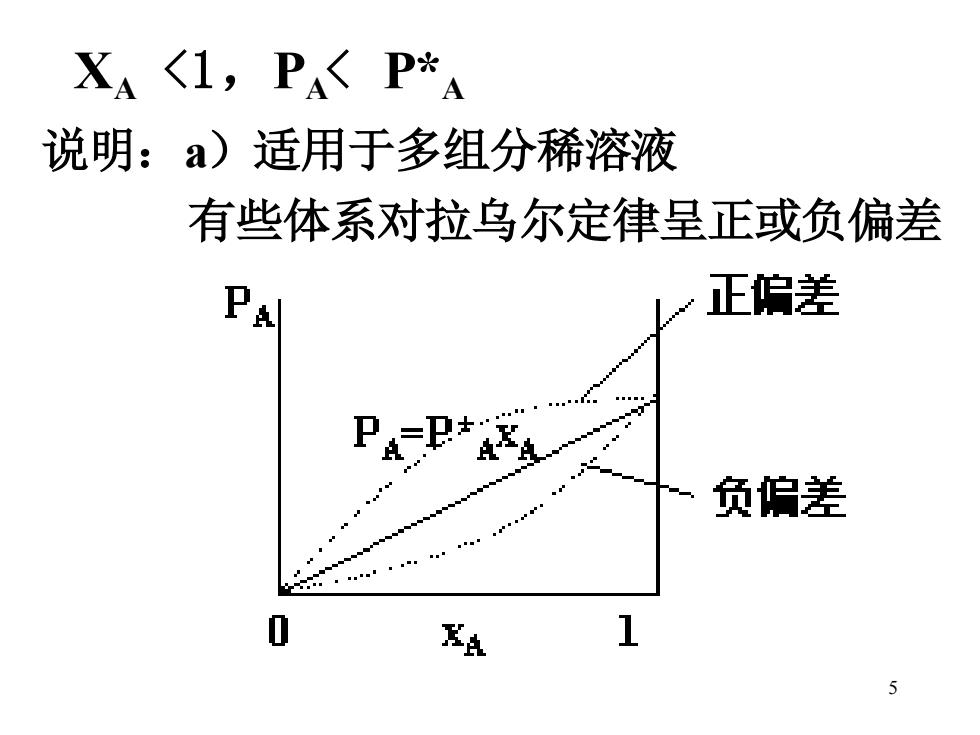
XA〈1,PP*A 说明:a)适用于多组分稀溶液 有些体系对拉乌尔定律呈正或负偏差 正偏姜 负伯差 尽点 1 5
5 XA <1,PA < P*A 说明:a)适用于多组分稀溶液 有些体系对拉乌尔定律呈正或负偏差