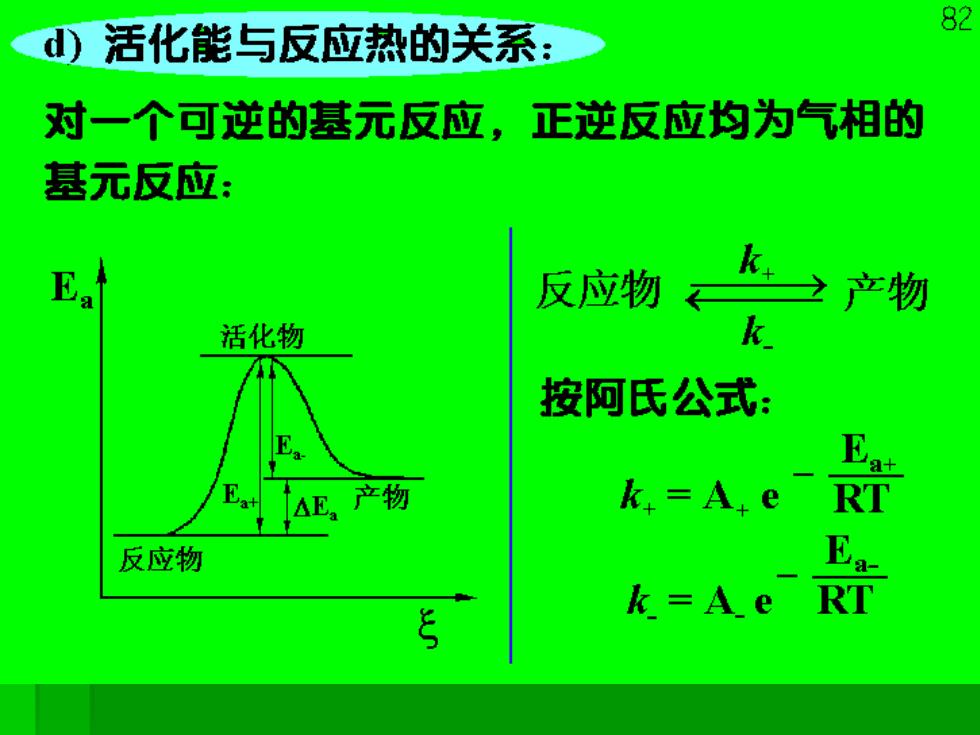
82 d)活化能与反应热的关系: 对一个可逆的基元反应,正逆反应均为气相的 基元反应: 反应物 k之产物 活化物 按阿氏公式: 产物 k,=A.e RT 反应物 k=A e

8. 对于正反应,吸收Ea+【 的活化能变成活化分子, 反应生成产物,放出E的能量: 对于逆反应,吸收E的能量成为活化物后, 生成“反应物?放出Ea+的能量。 由反应物→产物,放出能量为△Ea。 △Ea=Ea+-Ea 由于活化能多数为正值,所以△E,的符号要看 正逆反应活化能的大小及反应进行的方向来确 定。这里的Ea,Ea+,Ea:,△E,的下标a表示 活化能,并无体系状态的意义,也就是没有考 虑等容或等压条件

84 下面对△E,的状态条件加以讨论: 基元气相反应: A+B C+D 对于气相反应,以P表示反应物浓度,则有 Tpt=kp+PAPB Tp.=kp-PcPD, 当反应达平衡时, r=r. 即 Ap+PAPB=Kp-PCPD:

PePD 85 = PAPB Kp=K8, Kg,以1atm.为标准的平衡常数, Kp=K.(2)。(aa) Vant-Hof公式: 把以上Kg代入, (2=)。(2),=

86 阿氏微分式: (2←),(2),=- 比较之后得: EP:-EP.-A,H=Qp 为等压平衡常数与反应热Q, 的关系,此时 △Ea=Qp=AH