
为什么产物形成量会达到平台?这时化学反应达到平衡,底物S仍然被转化成产物P, 但是产物P又以同样的速度转化成底物S,使反应体系的总产物量没有变化。 现在定量考察化学反应平衡。没有酶催化的条件下,正反应速度常数是k是104s1, 逆反应速度常数kR是106s,平衡常数K是两个速度常数的比值: 104s1 P 106s1 K=[P]/IS]=k/kR=100。 不管有没有酶,化学反应平衡时产物P的量是底物S量的100倍。有酶存在,化学反 应能够很快达到平衡(表8.1)。因此酶只能加速化学反应达到平衡,但是不能改变化学平衡 位点。平衡位点只是反应物和产物之间自由能差异。 83酶协助反应形成转化态加速化学反应 反应物和产物之间自由能差异只能解释化学反应的平衡位,点,不能解释酶促反应速度。 如何用热力学理论解释酶对化学反应的促进?这样,我们除了考虑反应的底物和产物之外, 还要考虑反应的化学途径。 化学反应将底物S转化成产物P的过程中经过转化中间态X*,其自由能比底物和产物 都高。SP* S。星号表示转化状态。转化态是处于转化结构分 子,其结构既不同于底物,也不同于产物,转化态稳定性很差,因此不被看作反应途径的一 种稳态物质,是反应过程中自由能最高的结构状态。转化态自由能与反应物自由能的差值是 活化自由能,用△G表示(图8.3)。△G=Gx-Gs Transition state,X+ △G(uncatalyzed) (catalyzed) Substrate aua AG for the reaction Product Reaction progress→ 图83酶能降低反应的活化自由能。酶通过降低活化自由能,促进化学反应。 注意活化自由能△G对化学反应的自由能改变△G没有贡献。因为将底物转化成转化态 输入的能量在转化态转化成产物时释放。活化自由能障碍首先提示酶不改变△G、促进反应 速度的机理:酶能降低反应的活化自由能,换句话说,酶有助于转化态形成。 了解酶促进反应速度,我们假定底物转化成转化态有一个平衡,即 K* S =X*------P K*是形成X*的平衡常数,V是X*形成产物的速度,与X*浓度成正比,即V∝[X*], 因为只有X*才能转化成产物。而X*浓度取决于活化自由能△G*。活化自由能愈大,X*浓 度愈低。因此反应的总速度V依赖于△G*
为什么产物形成量会达到平台?这时化学反应达到平衡,底物 S 仍然被转化成产物 P, 但是产物 P 又以同样的速度转化成底物 S,使反应体系的总产物量没有变化。 现在定量考察化学反应平衡。没有酶催化的条件下,正反应速度常数是 kF 是 10 - 4 s -1, 逆反应速度常数 kR是 10 -6 s -1,平衡常数 K 是两个速度常数的比值: 10 -4 s -1 S ============ P 10 -6 s -1 K = [P]/[S] = kF/kR = 100。 不管有没有酶,化学反应平衡时产物 P 的量是底物 S 量的 100 倍。有酶存在,化学反 应能够很快达到平衡(表 8.1)。因此酶只能加速化学反应达到平衡,但是不能改变化学平衡 位点。平衡位点只是反应物和产物之间自由能差异。 8.3 酶协助反应形成转化态加速化学反应 反应物和产物之间自由能差异只能解释化学反应的平衡位点,不能解释酶促反应速度。 如何用热力学理论解释酶对化学反应的促进?这样,我们除了考虑反应的底物和产物之外, 还要考虑反应的化学途径。 化学反应将底物 S 转化成产物 P 的过程中经过转化中间态 X*,其自由能比底物和产物 都高。 S -------- P* ----------- S。星号表示转化状态。转化态是处于转化结构分 子,其结构既不同于底物,也不同于产物,转化态稳定性很差,因此不被看作反应途径的一 种稳态物质,是反应过程中自由能最高的结构状态。转化态自由能与反应物自由能的差值是 活化自由能,用△G*表示(图 8.3)。△G* = Gx*- Gs 图 8.3 酶能降低反应的活化自由能。酶通过降低活化自由能,促进化学反应。 注意活化自由能△G*对化学反应的自由能改变△G 没有贡献。因为将底物转化成转化态 输入的能量在转化态转化成产物时释放。活化自由能障碍首先提示酶不改变△G、促进反应 速度的机理:酶能降低反应的活化自由能,换句话说,酶有助于转化态形成。 了解酶促进反应速度,我们假定底物转化成转化态有一个平衡,即 K* v S ===== X* -------- P K*是形成 X*的平衡常数,v 是 X*形成产物的速度,与 X*浓度成正比,即 v ∝ [X*], 因为只有 X*才能转化成产物。而 X*浓度取决于活化自由能△G*。活化自由能愈大,X*浓 度愈低。因此反应的总速度 V 依赖于△G*
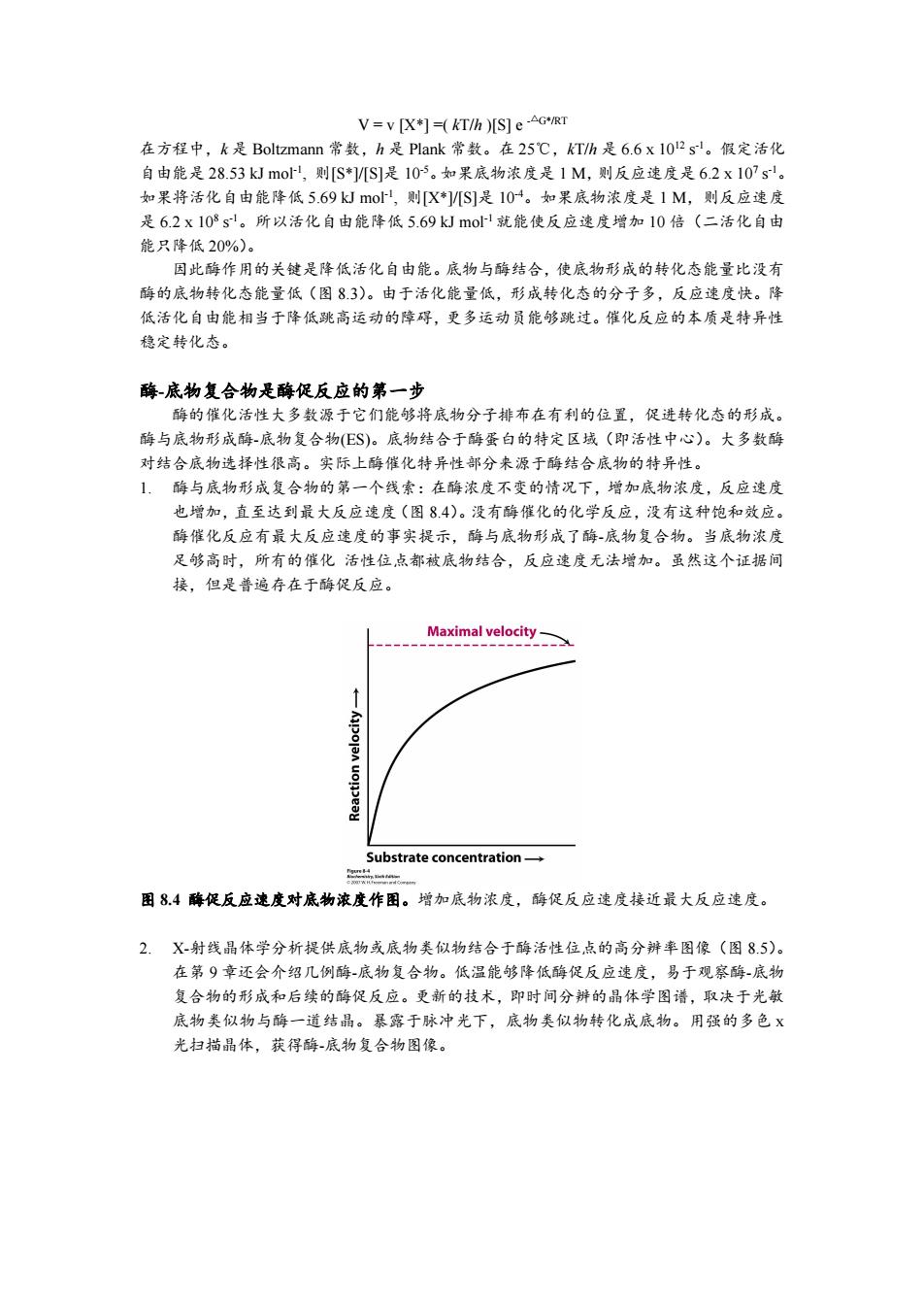
V=v [X+]=(KT/h )[s]e-AG*/RT 在方程中,k是Boltzmann常数,h是Plank常数。在25℃,kT/h是6.6x1012sl。假定活化 自由能是28.53kJmo,则[S*]/[S]是105。如果底物浓度是1M,则反应速度是6.2x107s'。 如果将活化自由能降低5.69kmo,则[X*/[S]是104。如果底物浓度是1M,则反应速度 是6.2x108s。所以活化自由能降低5.69 kJ mol-1就能使反应速度增加10倍(二活化自由 能只降低20%)。 因此酶作用的关键是降低活化自由能。底物与酶结合,使底物形成的转化态能量比没有 酶的底物转化态能量低(图83)。由于活化能量低,形成转化态的分子多,反应速度快。降 低活化自由能相当于降低跳高运动的障碍,更多运动员能够跳过。催化反应的本质是特异性 稳定转化态。 酶底物复合物是酶促反应的第一步 酶的催化活性大多数源于它们能够将底物分子排布在有利的位置,促进转化态的形成。 酶与底物形成酶-底物复合物(E$)。底物结合于酶蛋白的特定区域(即活性中心)。大多数酶 对结合底物选择性很高。实际上酶催化特异性部分来源于酶结合底物的特异性。 1,酶与底物形成复合物的第一个线索:在酶浓度不变的情况下,增加底物浓度,反应速度 也增加,直至达到最大反应速度(图8.4)。没有酶催化的化学反应,没有这种饱和效应。 酶催化反应有最大反应速度的事实提示,酶与底物形成了酶-底物复合物。当底物浓度 足够高时,所有的催化活性位点都被底物结合,反应速度无法增加。虽然这个证据间 接,但是普遍存在于酶促反应。 Maximal velocity- Substrate concentration- g点= 困8.4酶促反应速度对底物浓度作图。增加底物浓度,酶促反应速度接近最大反应速度。 2.X-射线晶体学分析提供底物或底物类似物结合于酶活性位,点的高分辨率图像(图8.5)。 在第9章还会介绍几例酶-底物复合物。低温能够降低酶促反应速度,易于观察酶-底物 复合物的形成和后续的酶促反应。更新的技术,即时间分辨的晶体学图谱,取决于光敏 底物类似物与酶一道结晶。暴露于脉冲光下,底物类似物转化成底物。用强的多色X 光扫描晶体,获得酶-底物复合物图像
V = v [X*] =( kT/h )[S] e -△G*/RT 在方程中,k 是 Boltzmann 常数,h 是 Plank 常数。在 25℃,kT/h 是 6.6 x 10 12 s -1。假定活化 自由能是 28.53 kJ mol -1 , 则[S*]/[S]是 10 -5。如果底物浓度是 1 M,则反应速度是 6.2 x 10 7 s -1。 如果将活化自由能降低 5.69 kJ mol -1 , 则[X*]/[S]是 10 -4。如果底物浓度是 1 M,则反应速度 是 6.2 x 10 8 s -1。所以活化自由能降低 5.69 kJ mol -1 就能使反应速度增加 10 倍(二活化自由 能只降低 20%)。 因此酶作用的关键是降低活化自由能。底物与酶结合,使底物形成的转化态能量比没有 酶的底物转化态能量低(图 8.3)。由于活化能量低,形成转化态的分子多,反应速度快。降 低活化自由能相当于降低跳高运动的障碍,更多运动员能够跳过。催化反应的本质是特异性 稳定转化态。 酶-底物复合物是酶促反应的第一步 酶的催化活性大多数源于它们能够将底物分子排布在有利的位置,促进转化态的形成。 酶与底物形成酶-底物复合物(ES)。底物结合于酶蛋白的特定区域(即活性中心)。大多数酶 对结合底物选择性很高。实际上酶催化特异性部分来源于酶结合底物的特异性。 1. 酶与底物形成复合物的第一个线索:在酶浓度不变的情况下,增加底物浓度,反应速度 也增加,直至达到最大反应速度(图 8.4)。没有酶催化的化学反应,没有这种饱和效应。 酶催化反应有最大反应速度的事实提示,酶与底物形成了酶-底物复合物。当底物浓度 足够高时,所有的催化 活性位点都被底物结合,反应速度无法增加。虽然这个证据间 接,但是普遍存在于酶促反应。 图 8.4 酶促反应速度对底物浓度作图。增加底物浓度,酶促反应速度接近最大反应速度。 2. X-射线晶体学分析提供底物或底物类似物结合于酶活性位点的高分辨率图像(图 8.5)。 在第 9 章还会介绍几例酶-底物复合物。低温能够降低酶促反应速度,易于观察酶-底物 复合物的形成和后续的酶促反应。更新的技术,即时间分辨的晶体学图谱,取决于光敏 底物类似物与酶一道结晶。暴露于脉冲光下,底物类似物转化成底物。用强的多色 x 光扫描晶体,获得酶-底物复合物图像
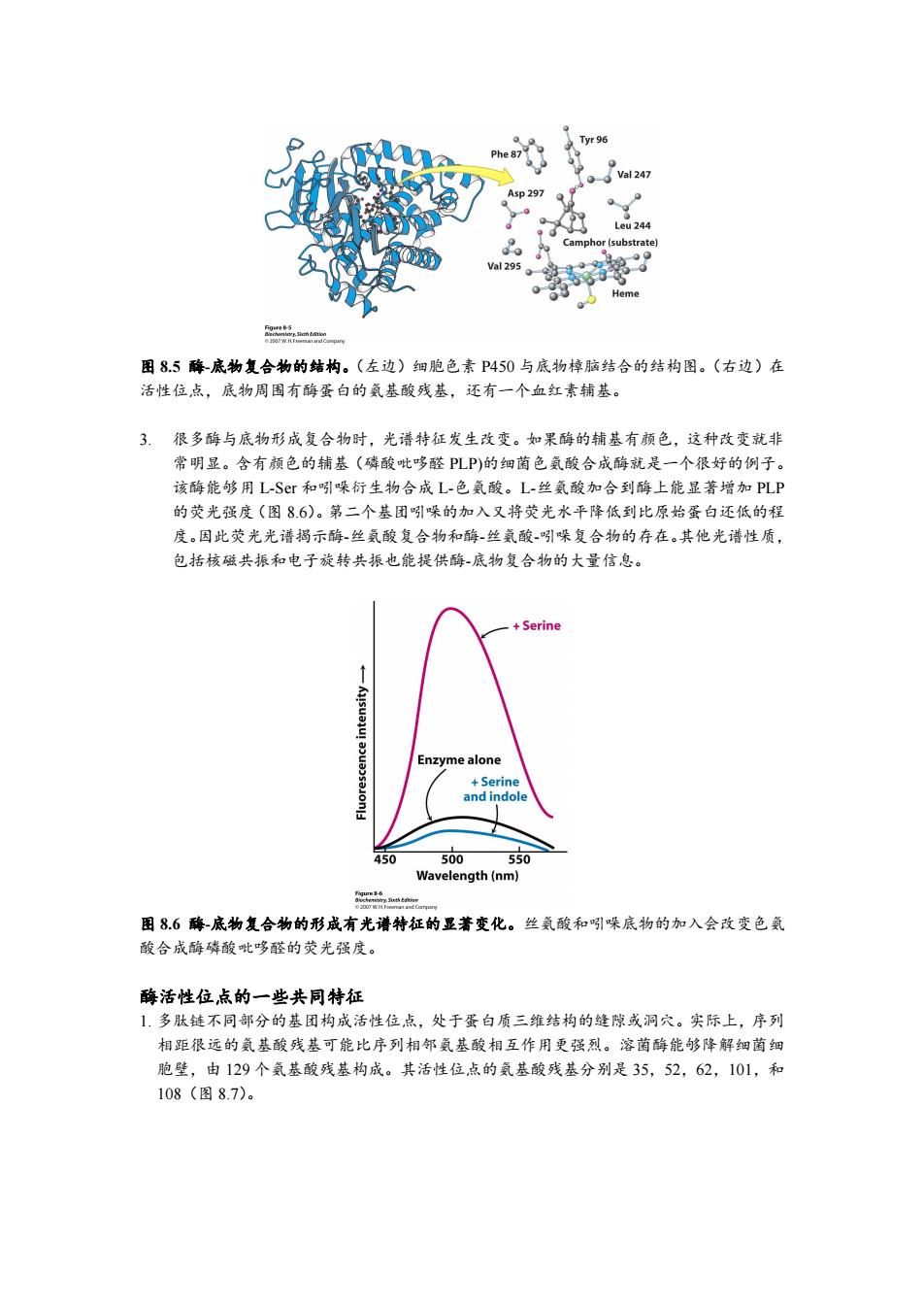
al247 sp297 eu244 phor(substrate) val295. 0 Heme 点 图8.5酶-底物复合物的结构。(左边)细胞色素P450与底物樟脑结合的结构图。(右边)在 活性位点,底物周围有酶蛋白的氨基酸残基,还有一个血红素辅基。 3.很多酶与底物形成复合物时,光谱特征发生改变。如果酶的辅基有颜色,这种改变就非 常明显。含有颜色的辅基(磷酸吡哆醛PLP)的细菌色氨酸合成酶就是一个很好的例子。 该酶能够用L-Sr和吲哚衍生物合成L-色氨酸。L-丝氨酸加合到酶上能显著增加PLP 的荧光强度(图8.6)。第二个基团吲引哚的加入又将荧光水平降低到比原始蛋白还低的程 度。因此荧光光谱揭示酶-丝氨酸复合物和酶-丝氨酸吲引哚复合物的存在。其他光谱性质, 包括核磁共振和电子旋转共振也能提供酶-底物复合物的大量信息。 +Serine Enzyme alone +Serine and indole 450 500 550 Wavelength(nm) btm 国86酶-底物复合物的形成有光谱特征的显著变化。丝氨酸和吲哚底物的加入会改变色氨 酸合成酶磷酸吡哆醛的荧光强度。 酶活性位,点的一些共同特征 1.多肽链不同部分的基团构成活性位点,处于蛋白质三维结构的缝隙或洞穴。实际上,序列 相距很远的氨基酸残基可能比序列相邻氨基酸相互作用更强烈。溶菌酶能够降解细菌细 胞壁,由129个氨基酸残基构成。其活性位点的氨基酸残基分别是35,52,62,101,和 108(图8.7)
图 8.5 酶-底物复合物的结构。(左边)细胞色素 P450 与底物樟脑结合的结构图。(右边)在 活性位点,底物周围有酶蛋白的氨基酸残基,还有一个血红素辅基。 3. 很多酶与底物形成复合物时,光谱特征发生改变。如果酶的辅基有颜色,这种改变就非 常明显。含有颜色的辅基(磷酸吡哆醛 PLP)的细菌色氨酸合成酶就是一个很好的例子。 该酶能够用 L-Ser 和吲哚衍生物合成 L-色氨酸。L-丝氨酸加合到酶上能显著增加 PLP 的荧光强度(图 8.6)。第二个基团吲哚的加入又将荧光水平降低到比原始蛋白还低的程 度。因此荧光光谱揭示酶-丝氨酸复合物和酶-丝氨酸-吲哚复合物的存在。其他光谱性质, 包括核磁共振和电子旋转共振也能提供酶-底物复合物的大量信息。 图 8.6 酶-底物复合物的形成有光谱特征的显著变化。丝氨酸和吲哚底物的加入会改变色氨 酸合成酶磷酸吡哆醛的荧光强度。 酶活性位点的一些共同特征 1. 多肽链不同部分的基团构成活性位点,处于蛋白质三维结构的缝隙或洞穴。实际上,序列 相距很远的氨基酸残基可能比序列相邻氨基酸相互作用更强烈。溶菌酶能够降解细菌细 胞壁,由 129 个氨基酸残基构成。其活性位点的氨基酸残基分别是 35,52,62,101,和 108(图 8.7)

(A) (B)N 355262,63101108129 图8.7活性位点包括氯基酸序列相差很远的氯基酸残基。(A)溶菌酶的绸缎结构示意图。 活性位,点的几个组分用颜色标出。(B)溶菌酶一级结构示意图显示,活性位点的氨基酸残 基处于多肽链不同区域。 2.活性位点只占酶分子体积的很小一部分。酶分子的大多数氨基酸残基不与底物接触,那么 酶为什么要做成这么大?几乎所有酶的长度都超过100个氨基酸残基,其质量超过10kD, 直径超过25A。活性位点之外的“额外”氨基酸充当分子骨架,使一级结构上差距很远的氨 基酸能够在一块购建成活性位点。而一级结构上相邻的氨基酸因空间障碍,无法构建出 活性位点必须的空间排列。很多蛋白质中,余下的氨基酸还构建酶分子的调节位点、与 其他蛋白质相互作用位点、或者将底物分子带入活性位,点的通道。 3.活性位点有独特的微环境。在结构已知的所有酶分子中,底物分子结合于酶分子的缝隙或 洞穴。除非水是反应物,这些缝隙或洞穴没有水分子。这些缝隙非极性的微环境促进底 物与酶分子之间的结合,有利于催化。然而,缝隙也可能含有极性残基。在活性位点所 处于的非极性微环境中,一些极性残基具有特别的性质,这些性质对底物结合或催化化 学反应是必需的。极性残基在分子内部的位置并不遵循暴露于水的极性氨基酸残基排布 的通用原则。 4.多种弱相互作用使底物与酶结合。ES复合物中分子间的非共价相互作用比共价键弱得多。 共价键能量介于-210至-460kmol之间。相反,ES复合物的解离常数是10-2至10-8M 之间,自由能只有-13至-50kJmo。如同1.3节所介绍的,这些弱的、可逆的相互作 用包括静电相互作用、氢镀、van der Waals力、和疏水力。当大量底物原子同时与酶分子 的很多原子同时接触,van der Waals力就是很显著的酶-底物复合物的结合力。因此,酶 与底物得有互补的外形。酶与底物分子间形成的氢键具有方向性,这个特征常常能够强 化酶促作用特异性,如降解RNA的核糖核酸酶(图8.8)。 Uracil (from substrate) Threo side chain Serine side chain 图88酶和底物之间形成的直健。核糖核酸酶与核酸底物的尿嘧啶之间形成氢键
图 8.7 活性位点包括氨基酸序列相差很远的氨基酸残基。(A)溶菌酶的绸缎结构示意图。 活性位点的几个组分用颜色标出。(B)溶菌酶一级结构示意图显示,活性位点的氨基酸残 基处于多肽链不同区域。 2. 活性位点只占酶分子体积的很小一部分。酶分子的大多数氨基酸残基不与底物接触,那么 酶为什么要做成这么大?几乎所有酶的长度都超过 100 个氨基酸残基,其质量超过 10kD, 直径超过 25A。活性位点之外的“额外”氨基酸充当分子骨架,使一级结构上差距很远的氨 基酸能够在一块购建成活性位点。而一级结构上相邻的氨基酸因空间障碍,无法构建出 活性位点必须的空间排列。很多蛋白质中,余下的氨基酸还构建酶分子的调节位点、与 其他蛋白质相互作用位点、或者将底物分子带入活性位点的通道。 3. 活性位点有独特的微环境。在结构已知的所有酶分子中,底物分子结合于酶分子的缝隙或 洞穴。除非水是反应物,这些缝隙或洞穴没有水分子。这些缝隙非极性的微环境促进底 物与酶分子之间的结合,有利于催化。然而,缝隙也可能含有极性残基。在活性位点所 处于的非极性微环境中,一些极性残基具有特别的性质,这些性质对底物结合或催化化 学反应是必需的。极性残基在分子内部的位置并不遵循暴露于水的极性氨基酸残基排布 的通用原则。 4. 多种弱相互作用使底物与酶结合。ES 复合物中分子间的非共价相互作用比共价键弱得多。 共价键能量介于-210 至 -460 kJ mol -1 之间。相反,ES 复合物的解离常数是 10 -2至 10 -8M 之间,自由能只有-13 至 -50 kJ mol -1。如同 1.3 节所介绍的,这些弱的、可逆的相互作 用包括静电相互作用、氢键、van der Waals 力、和疏水力。当大量底物原子同时与酶分子 的很多原子同时接触,van der Waals 力就是很显著的酶-底物复合物的结合力。因此,酶 与底物得有互补的外形。酶与底物分子间形成的氢键具有方向性,这个特征常常能够强 化酶促作用特异性,如降解 RNA 的核糖核酸酶(图 8.8)。 图 8.8 酶和底物之间形成的氢键。核糖核酸酶与核酸底物的尿嘧啶之间形成氢键
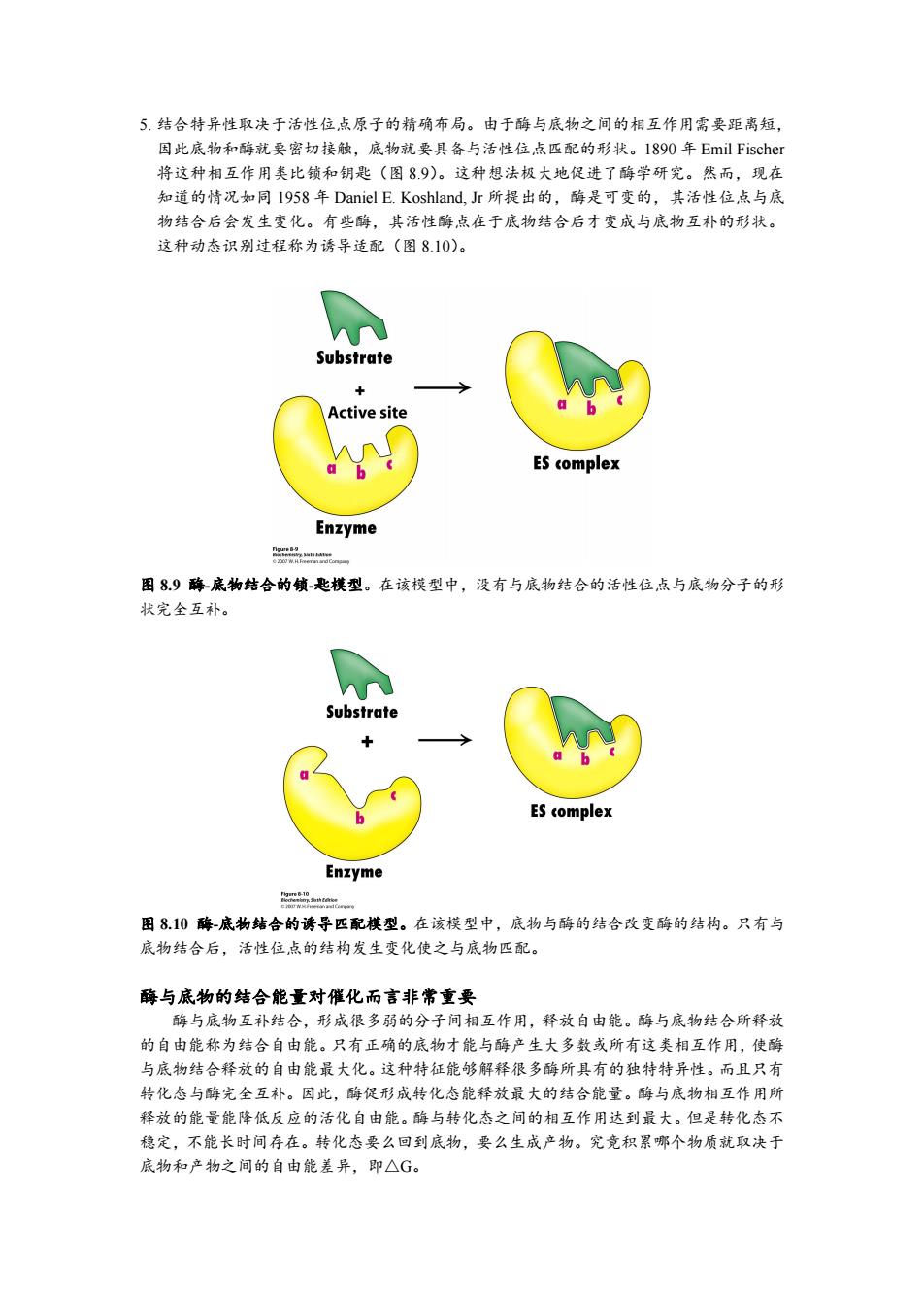
5.结合特异性取决于活性位,点原子的精确布局。由于酶与底物之间的相互作用需要距离短, 因此底物和酶就要密切接触,底物就要具备与活性位点匹配的形状。1890年Emil Fischer 将这种相互作用类比锁和钥匙(图89)。这种想法极大地促进了酶学研究。然而,现在 知道的情况如同I958年Daniel E.Koshland,Jr所提出的,酶是可变的,其活性位点与底 物结合后会发生变化。有些酶,其活性酶点在于底物结合后才变成与底物互补的形状。 这种动态识别过程称为诱导适配(图8.10)。 Substrate + Active site ES complex Enzyme 品 图89酶底物结合的饿-匙模型。在该模型中,没有与底物结合的活性位点与底物分子的形 状完全互补。 Substrate ES complex Enzyme 图810酶-底物结合的诱导匹配模型。在该模型中,底物与酶的结合改变酶的结构。只有与 底物结合后,活性位点的结构发生变化使之与底物匹配。 酶与底物的结合能量对催化而言非常重要 酶与底物互补结合,形成很多弱的分子间相互作用,释放自由能。酶与底物结合所释放 的自由能称为结合自由能。只有正确的底物才能与酶产生大多数或所有这类相互作用,使酶 与底物结合释放的自由能最大化。这种特征能够解释很多酶所具有的独特特异性。而且只有 转化态与酶完全互补。因此,酶促形成转化态能释放最大的结合能量。酶与底物相互作用所 释放的能量能降低反应的活化自由能。酶与转化态之间的相互作用达到最大。但是转化态不 稳定,不能长时间存在。转化态要么回到底物,要么生成产物。究竟积累哪个物质就取决于 底物和产物之间的自由能差异,即△G
5. 结合特异性取决于活性位点原子的精确布局。由于酶与底物之间的相互作用需要距离短, 因此底物和酶就要密切接触,底物就要具备与活性位点匹配的形状。1890 年 Emil Fischer 将这种相互作用类比锁和钥匙(图 8.9)。这种想法极大地促进了酶学研究。然而,现在 知道的情况如同 1958 年 Daniel E. Koshland, Jr 所提出的,酶是可变的,其活性位点与底 物结合后会发生变化。有些酶,其活性酶点在于底物结合后才变成与底物互补的形状。 这种动态识别过程称为诱导适配(图 8.10)。 图 8.9 酶-底物结合的锁-匙模型。在该模型中,没有与底物结合的活性位点与底物分子的形 状完全互补。 图 8.10 酶-底物结合的诱导匹配模型。在该模型中,底物与酶的结合改变酶的结构。只有与 底物结合后,活性位点的结构发生变化使之与底物匹配。 酶与底物的结合能量对催化而言非常重要 酶与底物互补结合,形成很多弱的分子间相互作用,释放自由能。酶与底物结合所释放 的自由能称为结合自由能。只有正确的底物才能与酶产生大多数或所有这类相互作用,使酶 与底物结合释放的自由能最大化。这种特征能够解释很多酶所具有的独特特异性。而且只有 转化态与酶完全互补。因此,酶促形成转化态能释放最大的结合能量。酶与底物相互作用所 释放的能量能降低反应的活化自由能。酶与转化态之间的相互作用达到最大。但是转化态不 稳定,不能长时间存在。转化态要么回到底物,要么生成产物。究竟积累哪个物质就取决于 底物和产物之间的自由能差异,即△G