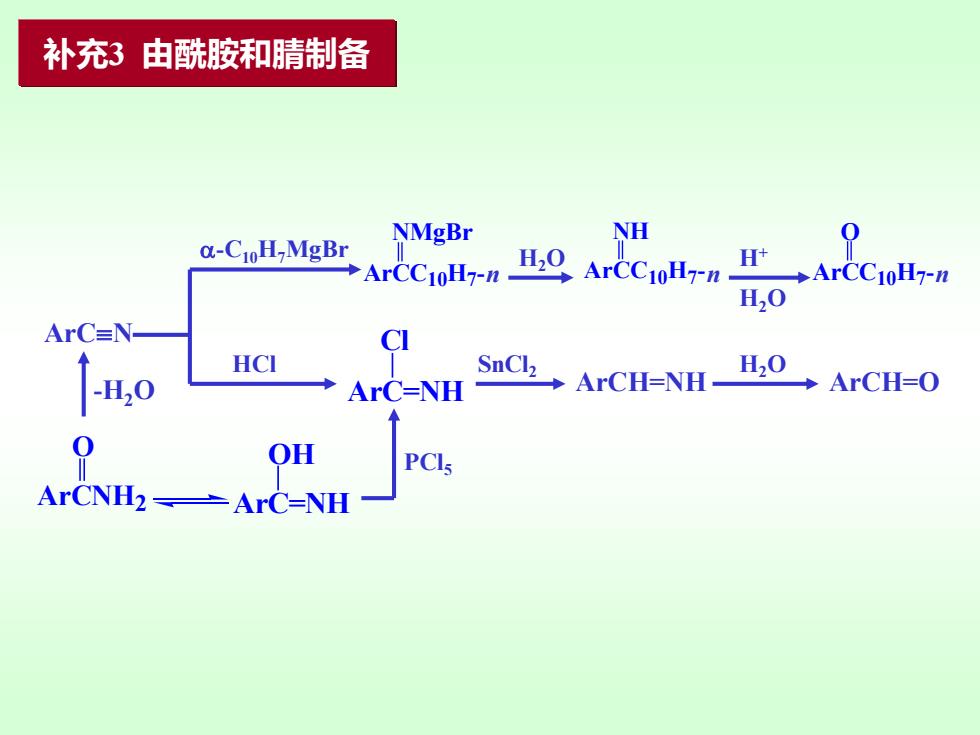
补充3由酰胺和腈制备 NMgBr NH @-CioH-MgBr 0 →ArCC1oH7-n- n,0ArCC1oH7-n →ArCC10H7-n H,0 ArC=N CI HCI -H20 ◆ArC=NH SaCk ArCH-NH-H0 ArCH-O OH
ArCN ArCNH2 O -H2O -C10H7MgBr ArCC10H7 -n NMgBr H2O ArCC10H7 - NH n H2O H+ ArCC10H7 - O n HCl ArC=NH Cl ArC=NH OH PCl5 SnCl2 ArCH=NH H2O ArCH=O 补充3 由酰胺和腈制备
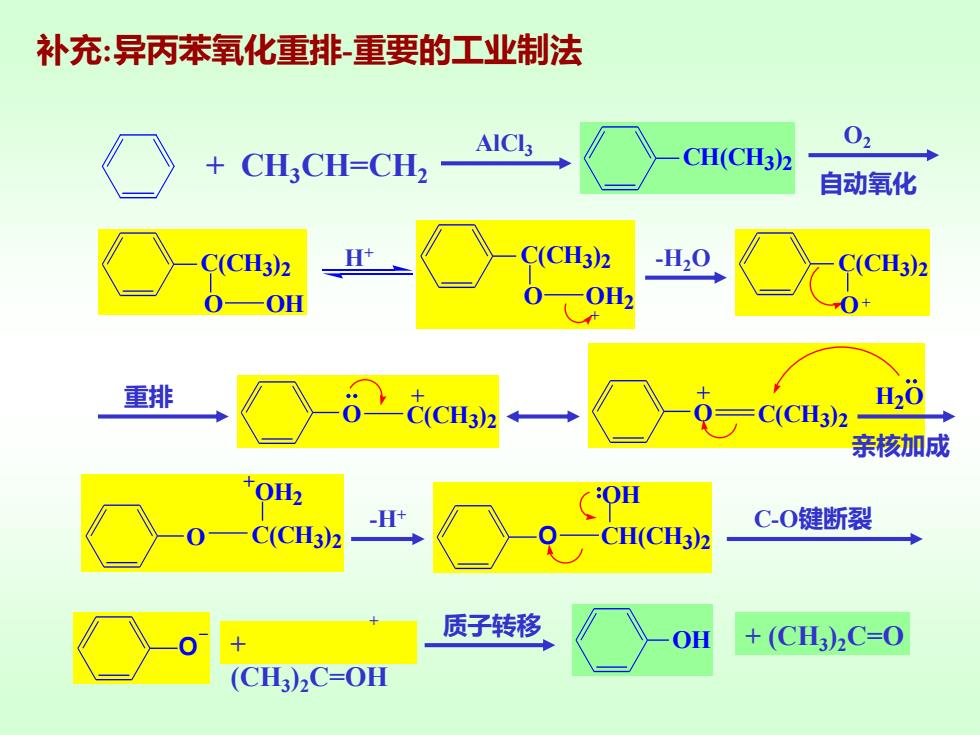
补充:异丙苯氧化重排重要的工业制法 02 CH:CH=CH2 CH(CH3)2 自动氧化 C(CH3)2 H C(CH3)2 -H20 CH3)2 0H 0-0H2 重排 C(CH3)2 H20 C(CH3)2 亲核加成 OH2 OH -H+ C(CH3)2 CH(CH3)2 C-0键断裂 质子转移 OH +(CH)2C=0 (CH3)2C=OH
补充:异丙苯氧化重排-重要的工业制法 + CH3CH=CH2 AlCl3 CH(CH3 )2 O2 自动氧化 C(CH3 )2 O OH H+ C(CH3 )2 O OH2 + -H2O C(CH3 )2 O+ 重排 O C(CH3 )2 +OH2 O C(CH3 )2 + O C(CH3 )2 + H2O -H+ O _ O CH(CH3 )2 OH C-O键断裂 亲核加成 + (CH3 )2C=OH + OH + (CH3 ) 质子转移 2C=O
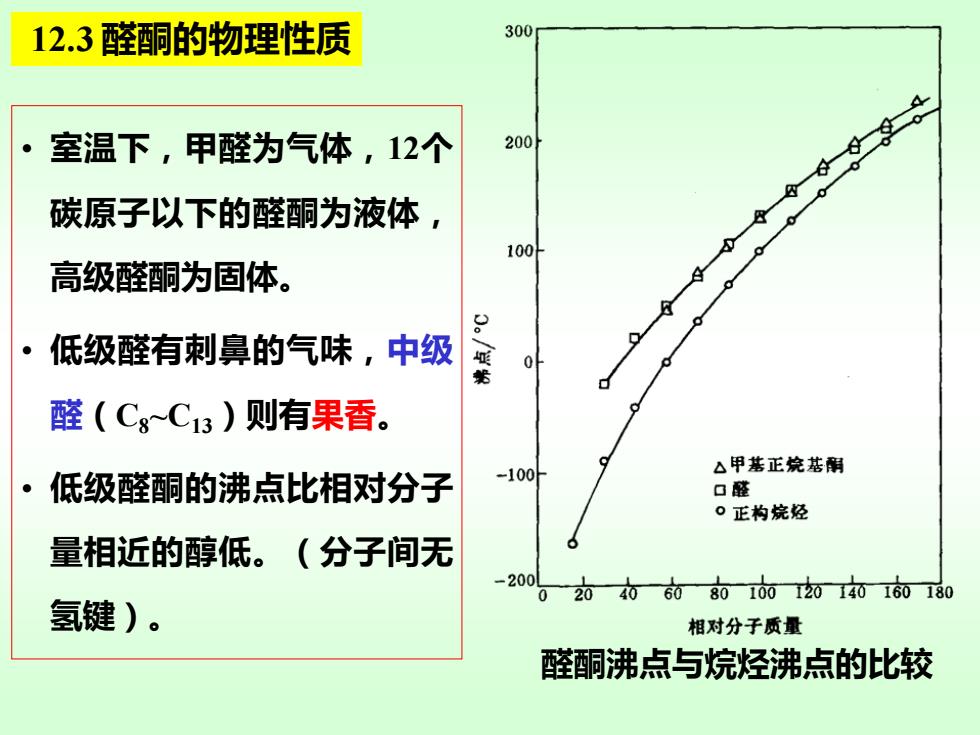
12.3醛酮的物理性质 300 室温下,甲醛为气体,12个 200 。 碳原子以下的醛酮为液体 100 高级醛酮为固体。 ·低级醛有刺鼻的气味,中级 0 醛(Cg~C13)则有果香。 -100 △甲基正烷基酮 低级醛酮的沸点比相对分子 口醛 。正构烷经 量相近的醇低。(分子间无 -200 02040608010012014016080 氢键)。 相对分子质量 醛酮沸点与烷烃沸点的比较
• 室温下,甲醛为气体,12个 碳原子以下的醛酮为液体, 高级醛酮为固体。 • 低级醛有刺鼻的气味,中级 醛(C8~C13)则有果香。 • 低级醛酮的沸点比相对分子 量相近的醇低。(分子间无 氢键)。 12.3 醛酮的物理性质 醛酮沸点与烷烃沸点的比较

沸点 正戊烷 乙醚丁醛丁酮丁醇丙酸 Mr 72 72 72 72 74 74 bp/℃36 34.676 80 118 141 羧酸>醇>醛、酮>烷烃、醚 氢键 极性 溶解度 氢键 甲醛、乙醛、丙酮易溶于水· 6个碳以上醛、酮不溶于水
沸点 正戊烷 乙醚 丁醛 丁酮 丁醇 丙酸 Mr 72 72 72 72 74 74 bp/℃ 36 34.6 76 80 118 141 羧酸 醇 醛、酮 烷烃、醚 氢键 极性 溶解度 甲醛、乙醛、丙酮易溶于水 6个碳以上醛、酮不溶于水 氢键?
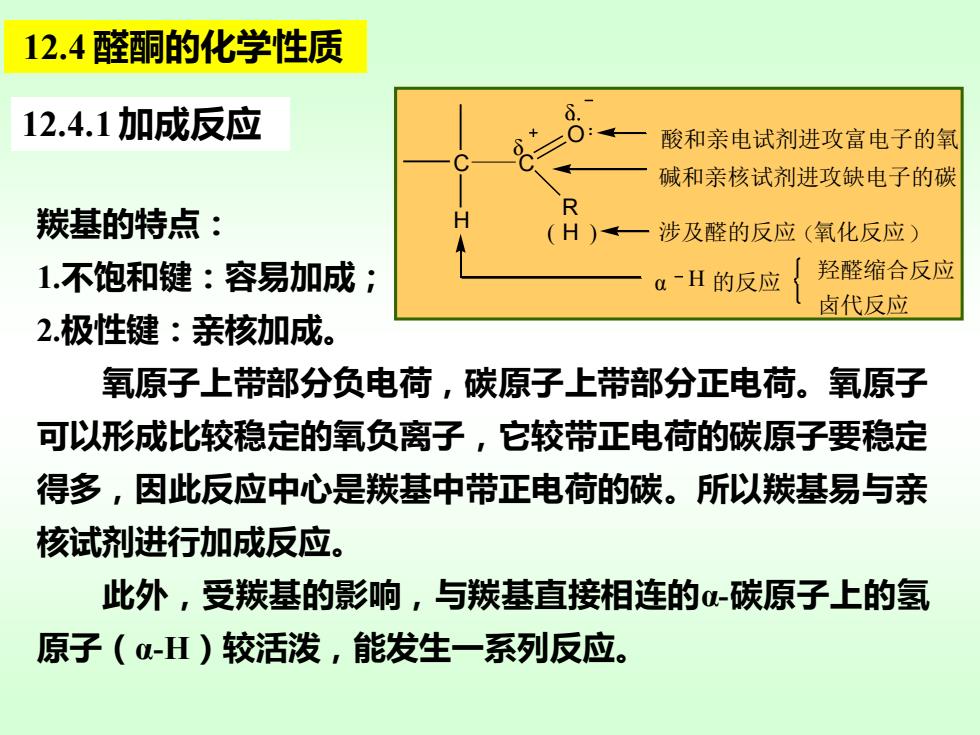
12.4醛酮的化学性质 12.4.1加成反应 酸和亲电试剂进攻富电子的氧 碱和亲核试剂进攻缺电子的碳 R 羰基的特点: (H)一涉及醛的反应(氧化反应) 1.不饱和键:容易加成; aH的反应 羟醛缩合反应 卤代反应 2极性键:亲核加成。 氧原子上带部分负电荷,碳原子上带部分正电荷。氧原子 可以形成比较稳定的氧负离子,它较带正电荷的碳原子要稳定 得多,因此反应中心是羰基中带正电荷的碳。所以羰基易与亲 核试剂进行加成反应。 此外,受羰基的影响,与羰基直接相连的α-碳原子上的氢 原子(-H)较活泼,能发生一系列反应
12.4 醛酮的化学性质 12.4.1 加成反应 羰基的特点: 1.不饱和键:容易加成; 2.极性键:亲核加成。 氧原子上带部分负电荷,碳原子上带部分正电荷。氧原子 可以形成比较稳定的氧负离子,它较带正电荷的碳原子要稳定 得多,因此反应中心是羰基中带正电荷的碳。所以羰基易与亲 核试剂进行加成反应。 此外,受羰基的影响,与羰基直接相连的α-碳原子上的氢 原子(α-H)较活泼,能发生一系列反应。 C C R O H ( H ) δ δ 酸和亲电试剂进攻富电子的氧 碱和亲核试剂进攻缺电子的碳 涉及醛的反应(氧化反应) α H 的反应 羟醛缩合反应 卤代反应