
自从FIoy的“等活性理论”提出以来,许多人的工作证明并支持了这一简化处理, 同时也提出了它的局限性和近似性,“等活性理论”成立需满足以下条件: ①缩聚反应休系必须是真溶液,均相体系,全部反应物,中间物和最终产物都溶 于这个介质中, 官能团所处的环境 邻近基团效应和空间阻碍在反应过程中不变: ③聚合物的相对分子质量不能太高,反应速率不能太大,反应体系粘度不能太高, 以不致影响小分子产物逸出、不妨碍建立平衡为限,不能使扩散成为控制速度的主要因 素。 2.2.5官能团不等活性体系 在某些情况下,官能团等活性的概念会出现偏差甚至不正确。产生这种情况的原因 有化学因素也有物理因素。 对某些体系而言,造成官能团活性差别的原因是官能团的空间环境和电子环境发生 了变化。如2,4-二异氰酸甲酯是合成聚酰基甲酸稽的常用单体,但它的两个官能团活性 并不相等,表2-4列举37.9℃ E乙胺催化不同异氰酸酯与正丁醇在甲苯中的反应活 性。可以看出:对位甲基的存在使异氰酸酯基的亲电能力下降,反应活性降低:而异氰 酸酯基的吸电子作用可以活化第二个异氰酸酯基,但如发生反应生成氨基甲酸酯基后, 其吸电子作用下降,又使第二个异氰酸酯基活性降低。 表2-4 异氰酸酯与正丁醉的反应活性 异氰酸醋 速率常数/L·mol·min k k k./k 单异氬酸酯 异氰酸苯基 异氰酸对甲苯基 0.406 0.210 异氰酸邻甲苯基酯 0.0655 “异氨酸酯 二异佩酸间亚苯基酯 434 0.517 8.39 二异氰酸对亚苯基酯 3.15 0.343 9.18 2,6 二异酸甲苯基 0.88 0.143 6.18 2,二异佩酸甲苯基 1.98 0.166 11.9 k:第一个活泼异氰酸酯基的反应速率常数 k:第一个活泼异氰酸酯基反应后,另一个异氰酸酯基的速率常数 再如由于乙二醇中羟基的亲核性大,因此比 一端酯化后余下的羟基活性大,而丙三 醇中仲羟基由于位阻作用,比二个伯羟基的活性要低。 对缩聚体系,如果在聚合过程中反应物发生相变,则可能会影响到官能团的活性。 表2-5列出溶剂对二苯基甲烷-4,4二异氰酸酯与乙二醇反应产物相对分子质量的影响。 表2-5溶剂对二苯基甲烷-4,4二异氰酸酯与乙二醇反应产物相对分子质量的影响 溶剂 聚合物的容解性 二甲苯 0.06 立刻沉淀 氯养 0.17 立刻沉淀 硝基苯 0.36 半小时后沉淀

一甲基亚网 0.69 溶解 *娶合温度1115℃ 二甲基甲酰胺中室温下测定 2.3线形逐步聚合反应的基本过程 2.3.1大分子的生长过程 这类反应的单体必须带有两个官能团,大分子的生长是由于官能团间相互反应的结 果。两种单体分子互相反应生成二聚体,二聚体与单体反应又生成三聚体,二聚体与 聚体反应得到四聚体, .,低聚物与低聚物相互反应生成分子量更大的聚合物。分子 量逐步长大, 分子链逐渐变长 小分子变为大分子的过程并不是无限制地进行的,实践证明缩聚物的分子量都不太 高,一般为10数量级。造成大分子不能继续增长的原因,既有热力学平衡的限制,也 有官能团失活导致的动力学终止。 2.3.2大分子生长过程的停止 正反应速度比反应速度大得多。随者反应进行,体系里反应物浓度不断减小,产物特别 是小分子产物浓度增加,使逆反应速度越来越明显。在缩聚反应后期,体系粘度很大, 生成的小分子不易除去。结构正逆反应速度相等,即达到热力学平衡。 缩聚反应的逆反应是解缩聚,例如聚酯合成中的醇解和酸解: √入R-O-R-0-C-R入√入 HORO-H入√入R-&-OROH HORO--R入入 R-80-R0-8R o8r8o一—R-8ow-8R&-oo8-R 000 这种化学降解使分子量降低。 在缩聚反应中还行在着大分子链之间的链交换反应,这种反应也是可逆的,尤其使 在较高温度下,这种可逆反应更应该收到重视。 入入RC-NHR入√入 C入RC-NHR-入入

这种链交换反应不影响体系分子链的数目,但却有利于分子量的均匀化,或者说, 链交换反应使聚合物的分子量分别变窄。通常分子量较大的分子对粘度影响较大,所以, 链交换反应使体系粘度下降。 如果将聚酰胺和聚酯放在一起进行链交换,会得到嵌段共聚物。 0 0 -0入-0 8-。8w 0 大分子链终止增长的另一个原因是缩聚反应中原料(官能团)的非化学计量比。 投料时即使设法准确称量,由于原理纯度和在反应过程中官能团的变化等原因,也不能 保证严格的化学计量比。从而造成反应体系中的一种官能团过量,当反应达到一定程度 后,大分子端基都由于原料纯度(特别是含单官能团物质)和在反应过程中官能团的变 化(如高温脱羧)等原因,使得反应体系中有一种官能团过量。反应达到一定高度后, 大分子端基部都被过量的官能团占有,缩聚反应被迫终止 2.3.1.2动力2终1日 动力学终止是由于官能团完全失去活性造成的,有以下几种情况: (1)单官能团物质封瑞 反应体系中含有单官能团物质起着封闭端基,终止大分子继续增长的作用,如: a-AB-nb+R'a -a-AB-R'+ab (2)环化反应 在一定条件下,线形缩聚反应同时伴有环化反应。环化反应依分子链的长短可以发 生在分子内,也可以发生在分子内,如分子内环化: H2N千CH23COOH CHz-CH2 CH2 NH +HO 0 Ho十CH与方COOH--CH,CH5C C=0+2H,O CH-0 单体间的环化反应: 一c 2 HNCH COOH 0=C C=0+2H20 另外,低聚物之间在一定条件下也可以进行环化反应: 一般随着聚合产物分子量的增大,聚合物分子末端功能基之间的碰撞概率下降,其 成环反应的动力学可行性下降;但其热力学稳定性增加。三 化发哪 有发生的难易程度取 决于上述动力学因素和热力学因素的综合作用。成环反应和缩聚反应是一对竞争反应, 如用己内酰胺制造尼龙一6时,总有7%的单体留下来,纺丝前必须用水洗去。用y一

氨基酸(丁基)、6一氨基酸(戊基)几乎得不到聚合物,只能得到相应的内酰胺。 对于线形缩聚反应来说,成环反应是一种副反应,应尽量避免。常用的措施有两个: ①增加单体浓度,线形缩聚是双分子反应,增加单体浓度对其有利: ②降低反应温度 不化反应活化能通常高于线 形 降低温度对后者有利, 分子内的环化反应也被利用,目的是合成环化低聚物和特殊性能的环化高分子。环 化低聚物可以用做开环聚合的单体。分子内环化通常利用局部的极稀浓度来实现,例如 双酚A氯甲酸酯的二氯甲烷溶液逐滴滴加到三乙胺的二氯甲烷溶液和NaOH水溶液的 混合物中,通过分子内环化反应得到双酚A聚碳酸酯环状低聚物: H,C、CH HC、CH EtN,CH2Cl,NaOH H3C CH (3)反应官能团的消除 在一定条件下,参加缩聚反应的单体、低聚物等容易发生官能团脱除反应或发生变 化 从而导致失去反应能力,如骏基在高温下易分解产生C0:氨基发生脱除氨气的反 等 2.4线形逐步反应动力学 2.4.1反应程度p 在逐步聚合中,带不同官能团的任何两分子都能相互反应,无特定的活性种,因此, 缩聚早期单体很快消失,转变成二聚体、三聚体等低聚物,单体的转化率很高。而相对 分子质量却很低。因此在逐步聚合反应中,转化率无甚意义,而改用反应程度来描述反 应的进程。 在逐步聚合反应中,官能团之间相互作用,其数目不断减少,生成物的相对分子质 量逐渐增加。因此把参加反应的官能团的数目与起始官能团的数目的比值称为反应程度 (extent of reaction),i记做p. 通常逐步聚合中,两单体采用等官能团配比。设起始官能团总数为N0,反应到 定程度后剩余官能团总数为N,则根据定义 =已参加反应的官能团数。N,-N (2-1) 起始官能团数 N. 如果将大分子结构中结构单元数定义为聚合度X。,则 X。=结构单元总数心 (2-2) 大分子数N
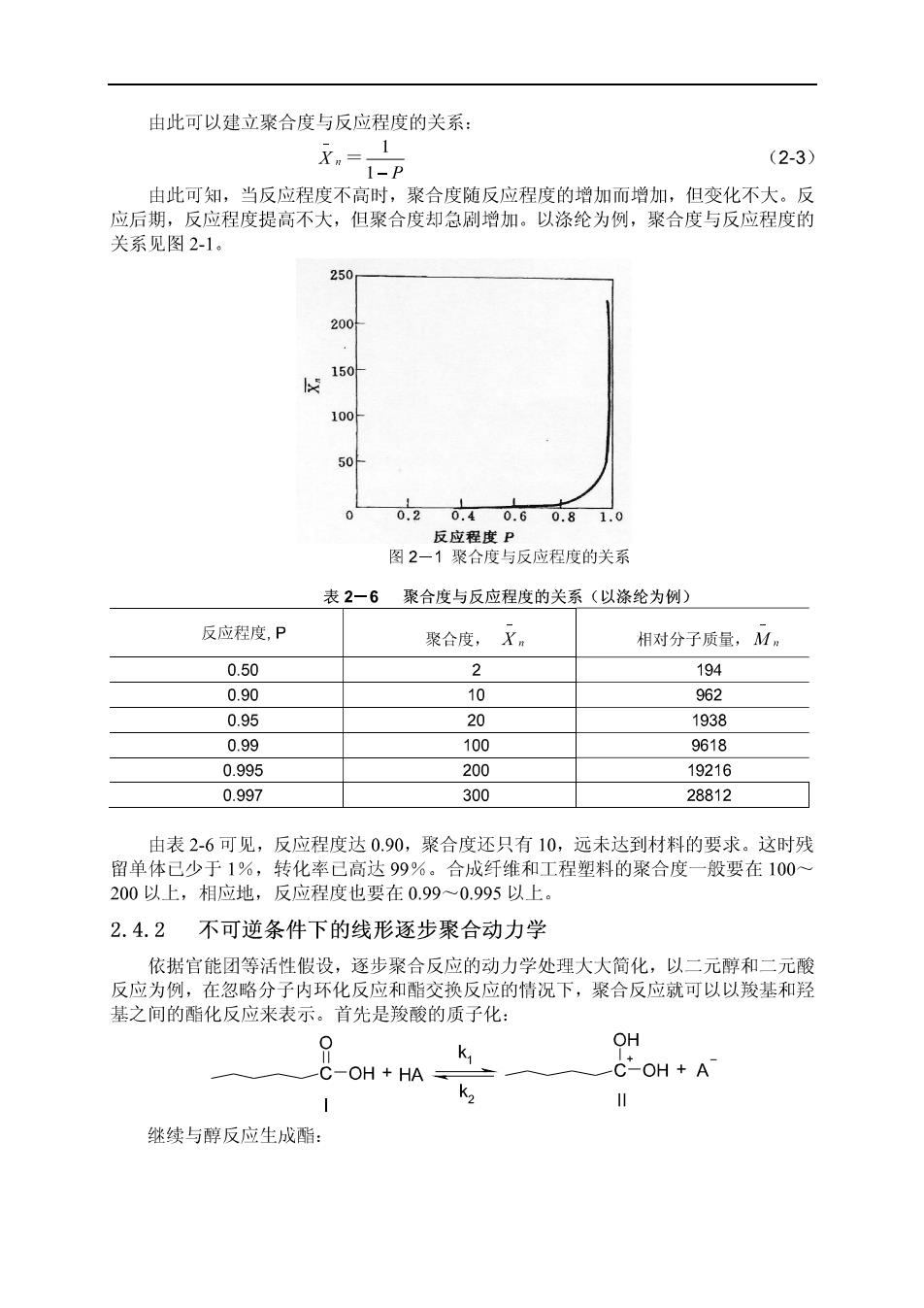
由此可以建立聚合度与反应程度的关系: Xm二1-P (2-3) 由此可知,当反应程度不高时,聚合度随反应程度的增加而增加,但变化不大。反 应后期,反应程度提高不大,但聚合度却急刷增加。以涤纶为例,聚合度与反应程度的 关系见图2-1。 250 200 45 100 50 020.40.60.8 1.0 反应程度P 图2一1聚合度与反应程度的关系 表2一6聚合度与反应程度的关系(以涤纶为例) 反应程度,P 聚合度,X。 相对分子质量,M 0.50 2 194 0.90 10 962 0.95 20 1938 0.99 100 9618 0.995 200 19216 0.997 300 28812 由表2-6可见,反应程度达0.90,聚合度还只有10,远未达到材料的要求。这时残 留单体已少于1%,转化率已高达99%。合成纤维和工程塑料的聚合度一般要在100~ 200以上,相应地,反应程度也要在0.99~0.995以上。 2.4.2 不可逆条件下的线形逐步聚合动力学 依据官能团等活性假设,逐步聚合反应的动力学处理大大简化,以二元醇和二元酸 反应为例,在忽略分子内环化反应和酯交换反应的情况下,聚合反应就可以以羧基和羟 基之间的酯化反应来表示。首先是羧酸的质子化: 0 k OH 一C-OH+HA= +A k 继续与醇反应生成酯: