
第三章 自由基聚合 3.1单体的聚合能力 种化合物能否用作单体进行聚合反应形成聚合物,需从化学结构、热力学和动力学等 方面进行分析。 从化学结构看,单体必须具有两个可相互反应的官能团才有可能形战线型聚合物。逐步 聚合中发生反应的官能团通常是一些典型的有机基团,如-OH、-COOH、-COC1、NH2、-C1、 H等。连锁聚合的单体主要有烯烃(包括共轭二烯烃)炔烃、基化合物和一些杂环化合物, 烯烃聚合发生反应的官能团主要是碳一碳双键,一个n键相当于两个宫能团:而碳基化合物中 的碳-氧双键、不稳定杂环化合物的碳-杂原子键等均可视为双官能团。 聚合反应的热力学和动力学研究是相辅相成的。热力学主要研究反应的方向、限度、平 衡等问题。在考忠某一化合物能否聚合时,需先做热力学分析。对热力学研究表明是不可能 的反应,没有必要进行动力学研究。因为一个没有推动力的反应,阻力再小也是不可能的 α-甲基苯乙矫在0℃常压下可以聚合,但在65℃以上需加压才能聚合:甲醛很容易聚合, 但乙醛在常温常压下却不能聚合:三、四元环单体容易聚合,而五、六元环的化合物则很难 聚合;在缩聚反应中,由于平衡的原因使单体残留于聚合物中,这些都属于热力学问题。动 力学主要研究反应的速度、机理等问题。热力学上可行的反应,动力学上不一定可行。常温 常压下,如没有引发剂,乙烯、丙烯不能聚合:异丁烯中只能通过阳离子聚合得到聚合物, 而苯乙烯却可通过多种聚合历程得到聚合物,这些都属于动力学问题。对于热力学可行的反 应,可通过动力学研究选择一个最佳的反应途径,以降低其反应活化能,加快反应速度,缩 短达到或接近平衡的时间。 3.1.1聚合热力学 聚合热力学主要研究聚合过程中能量的变化,进而判断单体聚合的可能性单体发生聚 合的热力学条件(如温度、压力):以及单体转化为聚合物的限度(最高转化率)等。 单体能否转变为聚合物,可由自由焓变化来判断。对于聚合反应,单体是初态,聚合物 是终态。根据热力学第二定律,自由能的烙、熵表达式为: △G=△H-T△S (3.1) 式中△G一聚合时自由能的变化(kJ/mol) △H一聚合时的烙变(kJ/mol) △s一聚合时的熵变(J/mol·K) T一热力学温度(K) 由式3-1可知,若聚合物的自由能比初态的单体自由能低,聚合反应可以自发发生,△G为 负值:反之,如聚合物的自由能大于起始单体的自由能,则△G为正值,聚合物将降解为单 体,即发生解聚反应。△G=0时,聚合和解聚处于可逆平衡状态。 以△G作为聚合反应能否进行的判,有以下几种情况: a.△H<0,△S>0此时△G总是负值,聚合反应在任何温度下都能发生。这类例子很

少,如结晶四聚甲醛聚合为晶态聚甲醛(△H=-3.32kJ/mol,△S=3.41kJ/mol). b.△H>0,△S<0此时△G总是正值,在任何情况下都不能形城聚合物。最典型的 例子是丙削(△H≈24kJ/mol,△S≈-111kJ/mol)。 c.△H<0,△S<0大多数单体的聚合反应都属于这一类,是我们讨论的重点。此类聚 合反应受反应温度影响很大,存在一个热力学最高聚合温度。 d△H>0,△S>0这种情况极少,如S环的聚合反应(△H=31.8kJ/mol,△S=13.8 k/mol)。与前一类相反,体系存在一个热力学最低聚合温度。 3.1.1.1聚合热 在聚合反应中的热效应称作聚合反应热,即聚合焓变△H。单体转变为聚合物的过程, 般为放热反应(△H<0)。根据热力学定律: △H=△E-P△V (3-2)》 对于多数聚合反应来说,尽管在聚合过程中有少量的体积收缩,但总体看可以忽路不计,即 △V≈0。因此聚合热相当于分子内能的变化,△H=△E。内能的变化可由三部分组成:键 能的变化、共轭、空间张力。由于键能的变化在内能的变化中起主要作用,因此可用聚合反 应前后键能变化的理论计官值来估算聚合执。 不饱和单体如烯类单体的聚合包含有一个n键的衡断裂,两个σ键的生成。打开一个双键 所需能量为609.2kJ/mol,形成一个单键放出的能量为-351.7kJ/mol,总的能量变化为: △H=2E。-E,=2×(-351.7) -(-609.2)=94.2kJ/mo 缩聚反应中,聚合热是其反应物在化学键重新组合时键能的变化值。如聚酰胺的聚合热可 由醋酸和氨的反应热进行估算: CHCOOH +H-NH2-CH;CONH2 +H-OH △H=-(E-十E十E+E)=-(304.8+463.1-358.0-391.1)=-18.8kJ/mol 几种不饱和单体聚合时键能的变化如表3-1所示。 表3-1几种不饱和单体聚合时健能的降低 链形(K/o1) 预计的聚合热(k/o1)■ C-N(615.5)→-CN304.8 23 从表3-1所列数据看,含C-0双键的醛或制类单体,聚合时的△H为正值,已知它们的 △S为负值,这似乎表明醛、酮类单体的聚合在热力学上是不可能的,但实际上,除丙酮外 醛类如甲醛、甲基丙烯醛等的△H均为负值,可以聚合。这说明用键能来计算聚合热并据此 判断单体能否聚合不够准确,还需要考虑共轭、空间张力等因素。后两者影响较小,需具体 问题具体分析。如共轭影响,要具体比较单体和聚合物重复单元共轭能的大小,因为反应总 是向生成共轭能大的产物方向进行。 乙烯的△H=-88.8kJ/moL,与计算值相差不大。但乙烯衍生物烯类单体的△H值却在 -30~-160kJ/o1之间波动。这种差异主要由下述原因引起: (1)取代基的位阻效应

聚合物链上取代基之间的空间张力使聚合热降低。这是由于取代基的空间效应对聚合物 的影响程度大于单体,当单体转变为聚合物后,原本可以在空间自由排布的取代基在聚合物 中受主链化学键的约束而挤在一起,免不了有键角的变化,键长的仲缩,非键合原子间的相 互作用等因素,从而心贮藏了部分内能,使聚合热有较为明显的下降。 实验事实证明,取代基的空间位阻张力能与取代基的范德华半径有关,与原子半径无关。 取代基数量的多少比其位置更重要,如a,B-二取代基之间的斥力不比a,a-二取代的大, 前者不易聚合主要是由于动力学原因,即单体分子接近活性中心时遇到了位阻障得。另外, 取代基对羰基的影响比碳碳双键大。 表3-2空间位阻对聚合热的影响 聚合热kJ/ol) 乙烯 -88.8 丙烯 -81.6 异丁烯 -54.0 苯乙烯 -69.9 口-甲基苯乙烯 -35.2 丙烯酸甲 甲基丙烯酸甲酯 留 甲醛 -21.0 乙醛 0 丙酮 25.1 (2)共轭效应 午名不物和单体的取代堪由干与不物和建形成共氟或超共郁而付单体有稳定作用,但形 成聚合物后,不饱和键的消失使共轭作用下降,导致由共轭产生的稳定作用明显下降。由共 轭或超共轭造成稳定能的不同使聚合热下降,降低的程度相当于单体的共振能。 苯乙烯为单取代乙烯,苯环与碳碳双键有共轭效应,因此苯乙烯聚合热(69.9kJ/1)较 计算值低。对α-甲基苯乙烯来说,苯基的共轭效应、甲基的超共轭效应、两个取代基的位阻 效应对聚合热的影响,方向一致,三者叠加,使聚合热大大降低(-35.2k灯/1)。 当取代基的共轭效应很弱或不存在时,如醋酸乙烯酯,聚合热与乙烯基本相似。 (3)强电负性取代基 当不饱和单体的碳-碳双键上带有电负性强的取代基时,聚合热往往比理论值高出许多。 如氟乙烯(-95.8k灯/o1入硝基乙烯(-90.8k灯/ol1)、俯二氟乙稀(-129.2kJ/o1)、四氟乙 烯(-154.8k/ol)等 对这种现象有几种解释。一种认为是由于聚合后强电负性基团上非键合电子间斥力减少: 种认为可能是由于分子间缔合作用使聚合物的稳定性增加:对四氟乙烯则认为可能是由于 氟原子范德华半径小,降低了氟原子间的斥力或可能与含氟烃类中碳碳键能较大有关。 (4)氢键和溶剂化作用 总体看影响小于以上三类,趋势上是使聚合热降低。主要是由于游离单体分子中氢键的 缔合作用比之相应聚合物中要强。如丙烯酸(67.0kJ/o1)、甲基丙烯酸(←42.3k/o1)在

很稀的水溶液或醇溶液中聚合氢键的影响可以显著地减少,比缔合液态时的聚合热要高出 12.6~209k/ol 3.1.1.2聚合嫡 体系嫡是该体系的统计几率或无序程度的量度。体系中分子、原子的排列和混合程度的 无序程度变大,熵值增加:反之,熵值降低。聚合反应是许多小分子单体通过共价键结合成 大分子的过程,体系无序程度下降,因而聚合反应是熵减过程,即△$<0。相反,由一个大 分子降解为单体或低聚合物的过程是嫡增过程。 气态单体的熵可以看为是其平动嫡S、外转动熵S、振动嫡S,和内振动熵S之和,即: S=S+S+S+S。而聚合物的熵只含有振动熵S和内振动熵S,二项值的增加大致与所 失去的外转动嫡相抓,因而聚合反应的熵减大致为聚合后失去的平动熵值。从实验数据看, 单体的结构,如共轭作用的大小、取代基的体积和数量等对单体的熵值姥响不大。可以认为 熵值是一个与结构无关的热力学函数,对烯类单体来说,△S大都在-100~-125JoK。 3.1.1.3聚合上限温度 对于大多数单体的聚合反应,△H<0,△S<0,要想使聚合反应正常进行(△G<0), 反应温度(T)的作用就非常重要了。 当聚合和解聚处于平衡状态时,△G=0,则△H=T△S。这时的反应温度称为聚合上限 温度(ceiling temperature),记为T。。高于这一温度,聚合反应无法进行。在热力学研究中, T。是一个重要参数 △T T.=AS (3-3) 严格来讲,任何聚合反应都是平衡反应。当温度达到T时,链增长与解聚达到平衡。即: Kp M·+M 两反应的速率方程为: Ro=kp[Ma:][M] (3-4) R=kM1 (35) 达平衡时,两反应速度相等 ko[Me:][M]=kdp[Mo+r] (3-6) 如果聚合度很大,则M·]=M1·】。此时平衡常数K与平衡单体浓度M间关系为: K=k、1 (3-7) kd IMI 在标准状态下: △G=△f一T△s=-RT1nk=RT1n[M0. (3-8) 平衡时,△G=0,T=T,则: T.= (3-9) △S9+RIn[M]. 或 -会-A9 (3-10)
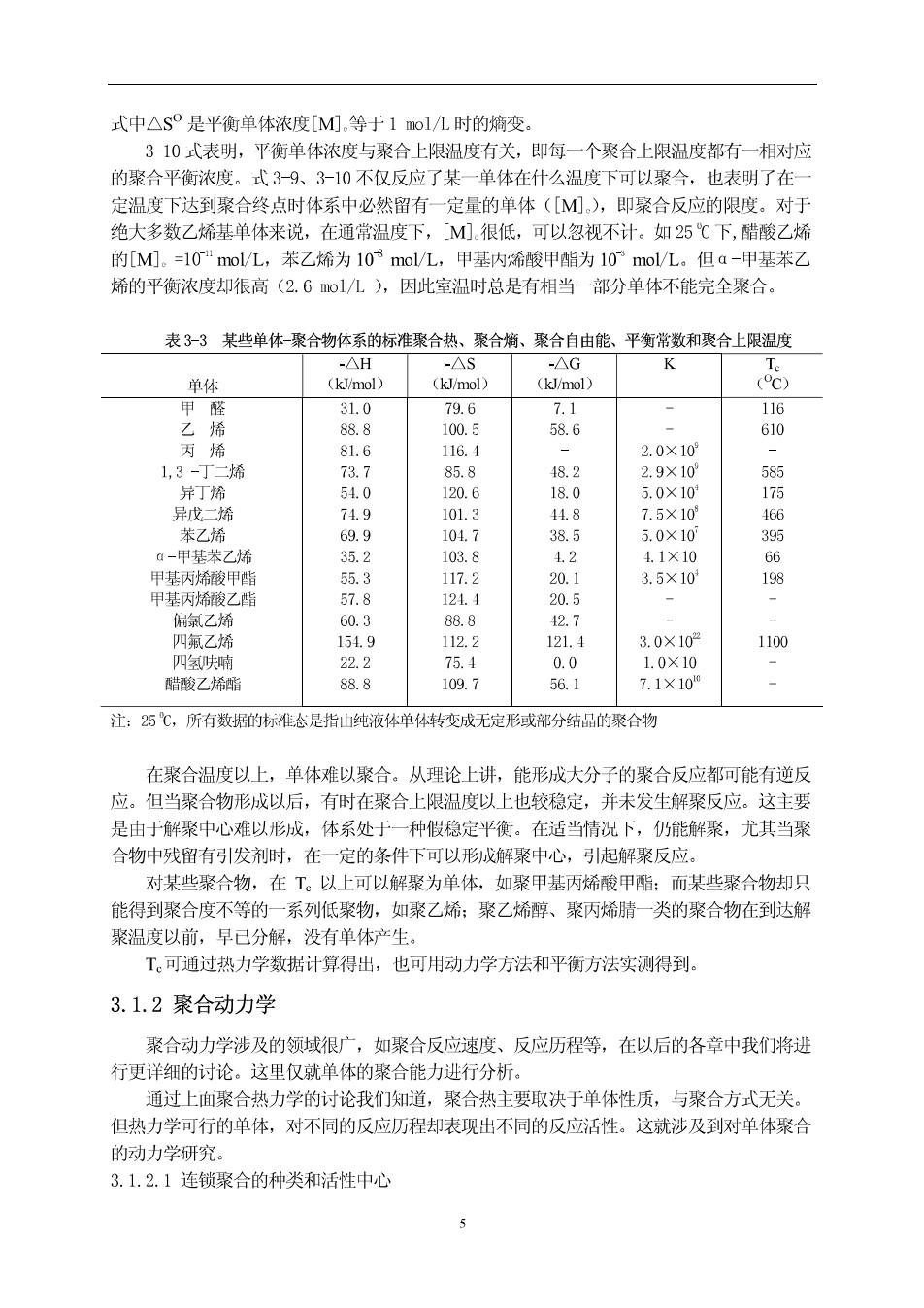
式中△s是平衡单体浓度[M).等于1mol/L时的熵变。 3-10式表明,平衡单体浓度与聚合上限温度有关,即每一个聚合上限温度都有一相对应 的聚合平衡浓度。式3-9、3-10不仅反应了某一单休在什么温度下可以聚合,也表明了在一 定温度下达到聚合终点时体系中必然留有一定量的单休([M),即聚合反应的限度。对于 绝大多数乙烯基单体来说,在通常温度下,[M)很低,可以忽视不计。如25℃下,醋酸乙烯 的[M.=10"mol/L,苯乙烯为10$mol/L,甲基丙烯酸甲酯为10°mol/L。但a-甲基苯乙 烯的平衡浓度却很高(2.61/L),因此室温时总是有相当一部分单体不能完全聚合。 表3-3某些单体-聚合物体系的标准聚合热、聚合、聚合自由能、平衡常数和聚合上限温度 单体 16 58.6 610 2.0×10 丁二烯 585 异丁 120 175 异戊二烯 101.3 75×10 166 茉了搭 6g g 1047 385 50×10 395 a-甲基茶乙摇 35.2 103.8 1. 1.1×10 G66 甲基丙烯酸甲酯 55.3 117.2 20.1 3.5×10 198 甲基丙希酸乙酯 57.8 121. 20.5 2.7 3.0×10 1100 2 109.7 69 7x10 注:25℃,所有数据的标准态是指山纯液体单体转变成无定形或部分结品的聚合物 在聚合温度以上,单体难以聚合。从理论上讲,能形成大分子的聚合反应都可能有逆反 应。但当聚合物形成以后,有时在聚合上限温度以上也较稳定,并未发生解聚反应。这主要 是由于解聚中心难以形城,体系处于一种假稳定平衡。在适当情况下,仍能解聚,尤其当聚 合物中残留有引发剂时,在一定的条件下可以形成解聚中心,引起解聚反应。 对某些聚合物,在T。以上可以解聚为单体,如聚甲基丙矫酸甲酯:而某些聚合物却只 能得到聚合度不等的一系列低聚物,如聚乙烯:聚乙烯醇、聚丙烯晴一类的聚合物在到达解 聚温度以前,早已分解,没有单休产生。 T。可通过热力学数据计算得出,也可用动力学方法和平衡方法实测得到。 3.1.2聚合动力学 聚合动力学涉及的领域很广,如聚合反应速度、反应历程等,在以后的各章中我们将进 行更详细的讨论。这里仅就单体的聚合能力进行分析 通过上面聚合热力学的讨论我们知道,聚合热主要取决于单体性质,与聚合方式无关。 但热力学可行的单体,对不同的反应历程却表现出不同的反应活性。这就涉及到对单体聚合 的动力学研究。 3.1.2.1车饰聚合的种类和活性中心