
组成可逆电池的必要条件 中东理子大名 SHANDONG UNIVERSITY OF TECHNOLOGY 将化学能转化为电能的装置称为电池,若此转化是 以热力学可逆方式进行的,则称为“可逆电池”。 在可逆电池中(A,Gm)p=W,=-zFE 其中E:电池两电极间的电势差,在可逆条件下,达 最大值,称为电池的电动势。 1.可逆电池充放电时的反应必须互为逆反应一物质 的转变可逆; 见下列两例 2.可逆电池中所通过的电流必须为无限小一能 量的转变可逆。 可逆电池必须同时满足上述两个条件
12 组成可逆电池的必要条件 1. 可逆电池充放电时的反应必须互为逆反应──物质 的转变可逆; 2.可逆电池中所通过的电流必须为无限小──能 量的转变可逆。 可逆电池必须同时满足上述两个条件. 见下列两例 将化学能转化为电能的装置称为电池,若此转化是 以热力学可逆方式进行的,则称为“可逆电池”。 在可逆电池中 (ΔrGm)T,p=Wr ’ =-zFE 其中E: 电池两电极间的电势差,在可逆条件下,达 最大值,称为电池的电动势
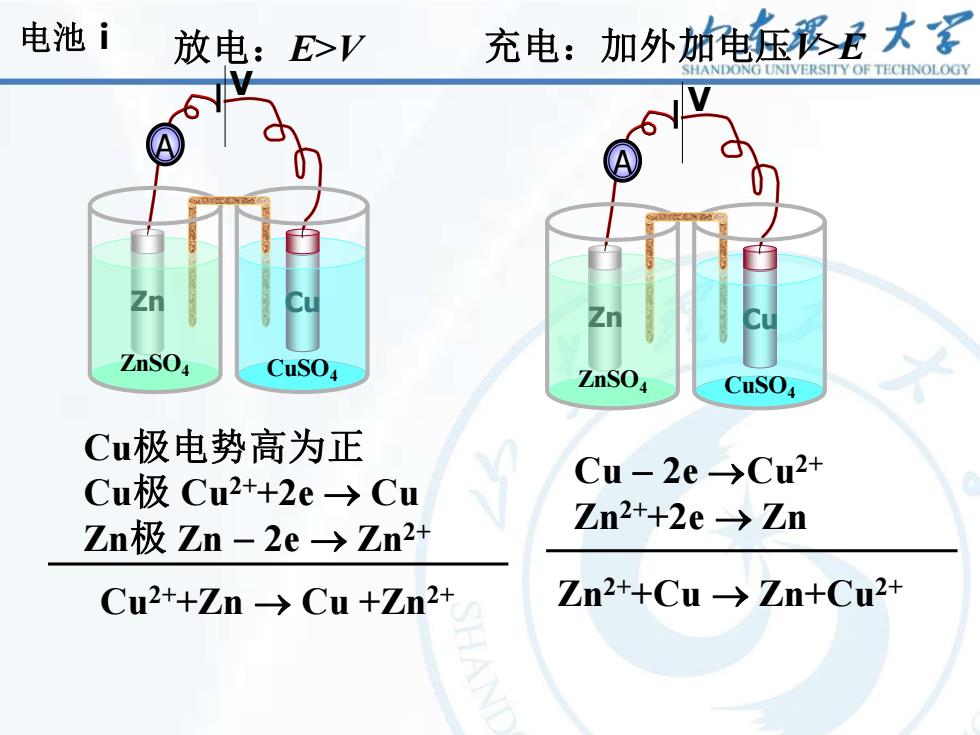
电池i 放电:E>V 充电:加外加电乐崧是大 SHANDONG UNIVERSITY OF TECHNOLOGY ZnSO CuSO ZnSO CuSO Cu极电势高为正 Cu极Cu2+2e→Cu Cu-2e→Cu2+ Zn极Zn-2e->Zn2+ Zn2++2e -Zn Cu2++Zn→Cu+Zn2+ Zn2++Cu→Zn+Cu2+
13 Cu极电势高为正 Cu极 Cu2++2e → Cu Zn极 Zn − 2e → Zn2+ Cu2++Zn → Cu +Zn2+ 放电:E>V 充电:加外加电压V>E Cu − 2e →Cu2+ Zn2++2e → Zn Zn2++Cu → Zn+Cu2+ 电池ⅰ Zn Cu ZnSO4 CuSO4 A V Zn Cu ZnSO4 CuSO4 A V
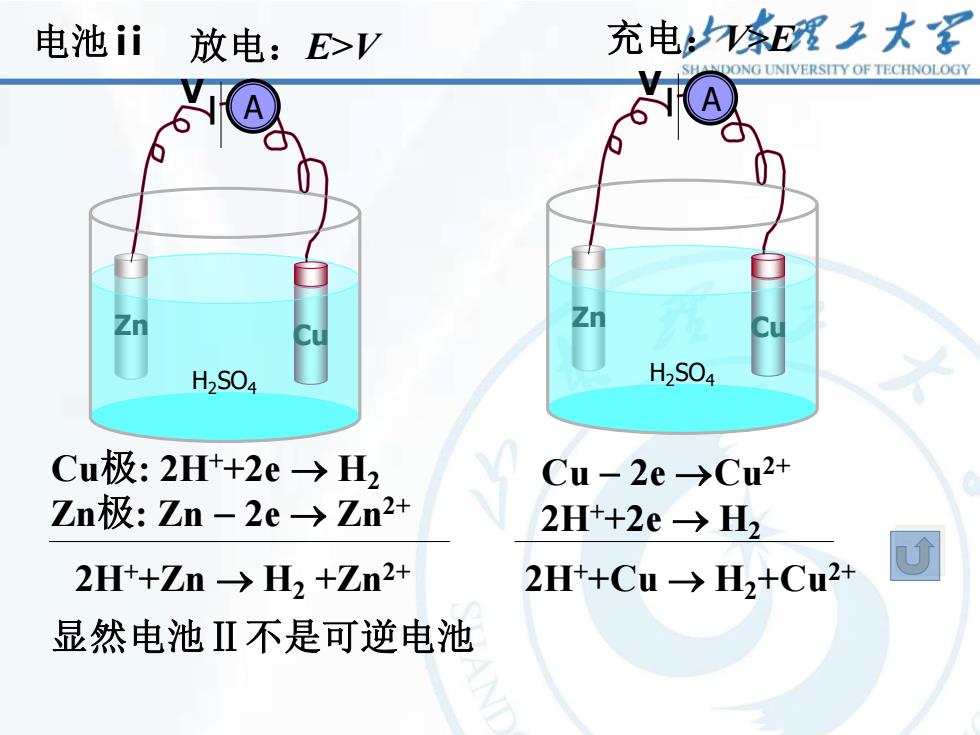
电池ii 放电:E>V 充电E理工大 ONG UNIVERSITY OF TECHNOLOGY H2S04 H2S04 Cu极:2H+2e→H2 Cu-2e→Cu2+ Zn极:Zn-2e→Zn2+ 2Ht+2e→H2 2H+Zn-→H2+Zn2+ 2Ht+Cu-→H2+Cu2+ 显然电池Ⅱ不是可逆电池
14 放电:E>V 充电:V>E Cu极: 2H++2e → H2 Zn极: Zn − 2e → Zn2+ Cu − 2e →Cu2+ 2H++2e → H2 2H++Zn → H2 +Zn2+ 2H++Cu → H2+Cu2+ 电池ⅱ Cu Zn H2SO4 A V Cu Zn H2SO4 A V 显然电池Ⅱ不是可逆电池
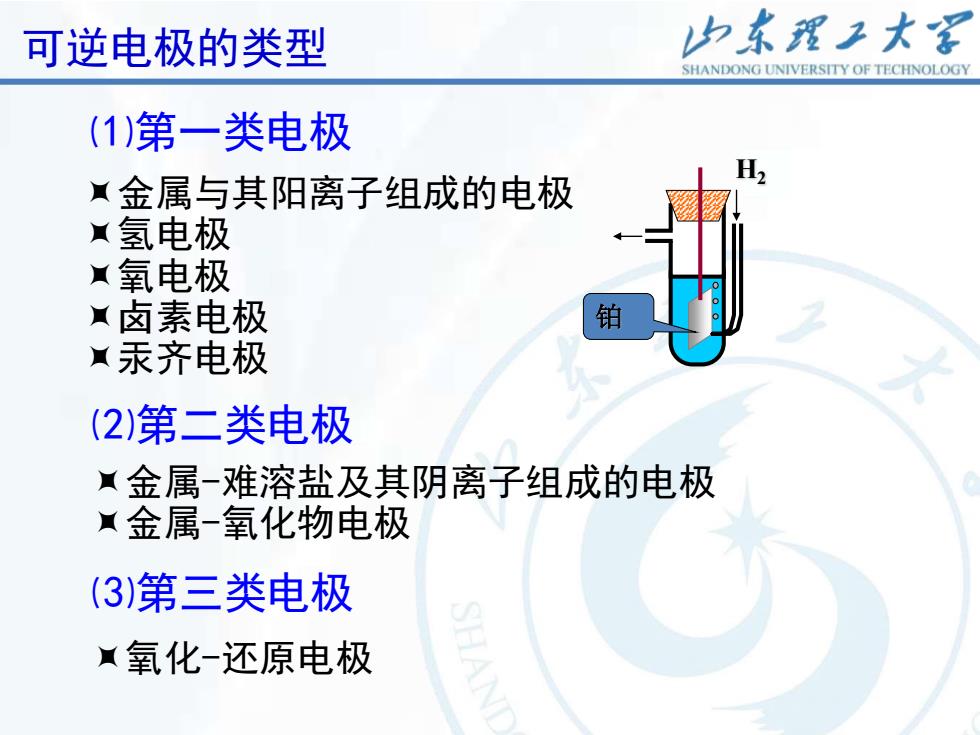
可逆电极的类型 归东理工大 SHANDONG UNIVERSITY OF TECHNOLOGY (1)第一类电极 金属与其阳离子组成的电极 氢电极 氧电极 卤素电极 铂 汞齐电极 (2)第二类电极 金属-难溶盐及其阴离子组成的电极 金属-氧化物电极 (3)第三类电极 氧化-还原电极
15 金属与其阳离子组成的电极 氢电极 氧电极 卤素电极 汞齐电极 金属-难溶盐及其阴离子组成的电极 金属-氧化物电极 氧化-还原电极 ⑴第一类电极 ⑵第二类电极 ⑶第三类电极 可逆电极的类型 H2 铂

第一类电极的电极反应 力东理子大 SHANDONG UNIVERSITY OF TECHNOLOGY 电极 电极反应(还原) M(a)M(s) M*(a)+ze→M(S) H(a)H,(p)Pt 2H(a)+2e→H,(p) OH(a )H,(p)Pt 2H,0+2e→H,(p)+2OH(a) H(a)1O,(p)1Pt 0,p)+4H(a)+4e→2H0) OH(a)1O,(p)1Pt 0,p)+2H,0+4e→4OH(a) CI(a)1 Cl,(p)Pt C1,p)+2e→2C1(a) Na(a)Na(Hg)(a) Na(a.)+nHg(1+e>Na(Hg)(a)
16 第一类电极的电极反应 电极 电极反应(还原) M ( ) M(s) z a + + ㅣ M ( ) e M(s) z a z + − + + → H ( ) H ( ) Pt 2 a p + + ㅣ ㅣ 2 2H ( ) 2e H ( ) a p + − + + → OH ( ) H ( ) Pt 2 a p − − ㅣ ㅣ 2 2 2H O 2e H ( ) 2OH ( ) p a − − − + → + H ( ) O ( ) Pt 2 a p + + ㅣ ㅣ O ( ) 4H ( ) 4e 2H O(l) 2 2 p a − + + + + → OH ( ) O ( ) Pt 2 a p − − ㅣ ㅣ O ( ) 2H O 4e 4OH ( ) 2 2 p a − − − + + → Cl ( ) Cl ( ) Pt 2 a p − − ㅣ ㅣ Cl ( ) 2e 2Cl ( ) 2 p a − − − + → Na ( ) Na(Hg)( ) a a + + ㅣ + Na Hg(l) e Na(Hg)( ) ( ) a n a − + + + →