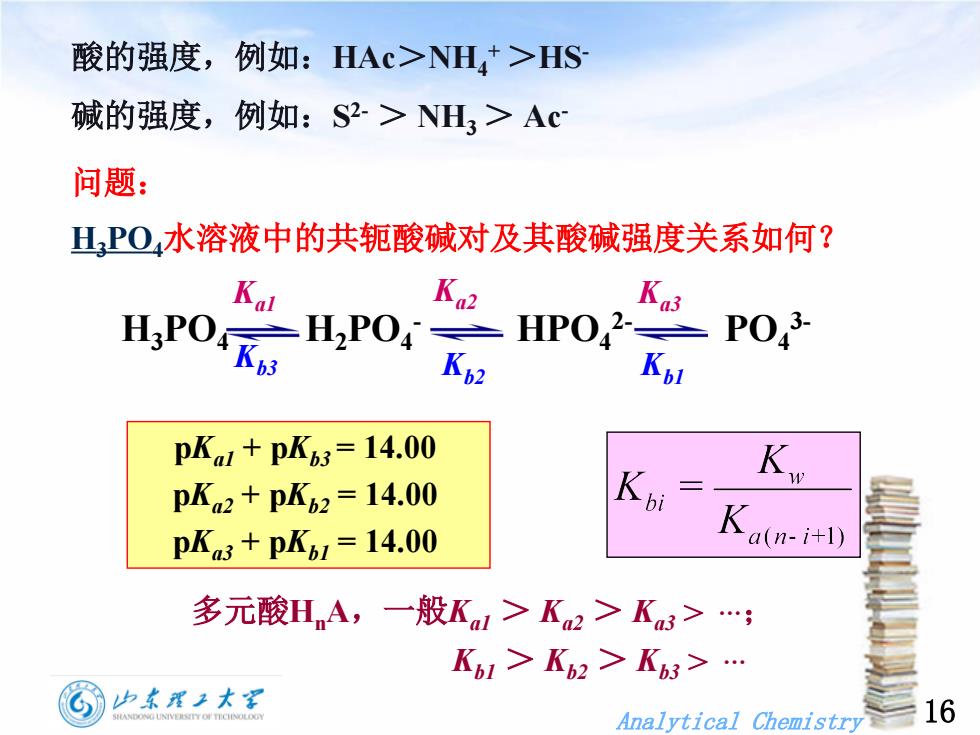
酸的强度,例如:HAc>NH+>HS碱的强度,例如:S2->NH,> Ac问题:H,PO水溶液中的共轭酸碱对及其酸碱强度关系如何?Ka2KalKa3PO,3-2HPO4H,POH,PO4Kb3Kb2KplpKal + pKb3 = 14.00KNKbipKa2 + pKb2 = 14.00Ka(n-i+l)pKa3 + pKb1 = 14.00多元酸H,A,一般K >Ka2 >Ka3>.Kb > Kb2 > Kb3 >山东翟工大学16HANDONGUNIVTSTOTICIINOLOGAnalytical Chemistry
Analytical Chemistry 16 酸的强度,例如:HAc>NH4 + >HS- 碱的强度,例如:S 2- > NH3 > Ac- 问题: H3PO4水溶液中的共轭酸碱对及其酸碱强度关系如何? H3PO4 H2PO4 - HPO4 2- PO4 3- Kb2 Kb1 Kb3 Ka1 Ka2 Ka3 pKa1 + pKb3 = 14.00 pKa2 + pKb2 = 14.00 pKa3 + pKb1 = 14.00 多元酸HnA,一般Ka1 > Ka2 > Ka3 > .; Kb1 > Kb2 > Kb3 >

3、酸碱中和反应(滴定反应)一酸碱解离反应的逆反应K一滴定反应常数(1)强酸强碱中和H+OH =H,O反应十分完全。K, =1/H+TOH-1=1/ K(碱)中和(2)强碱(酸)和弱酸NH, +h+ = NH.OH'+HAc=H,O+AcK, =[NH]/[NH,J[H]= K, / K,K, =[AcJ/[OH-JHAc]= K./ K,酸(碱)越弱,K,(K,)越小,K越小,反应越不完全。山东翟工大学17ANDONGUNIVTSTOTTCIINOLGAnalytical Chemistry
Analytical Chemistry 17 3、酸碱中和反应(滴定反应)—酸碱解离反应的逆反应 (1)强酸强碱中和 Kt—滴定反应常数 (2)强碱(酸)和弱酸(碱)中和 反应十分完全。 酸(碱)越弱,Ka(Kb)越小,Kt越小,反应越不完全

(3)弱酸弱碱中和NH,+HAc= NH+ AcK, =[NH+JAc ]/[NH,J[HAc] = K,K,/ K反应完全程度最小。由K可表示反应的完全程度,判断滴定的可行性。山东翟工大学18HANDONGUNIVTSTOTICINOLOGAnalytical Chemistry
Analytical Chemistry 18 (3)弱酸弱碱中和 反应完全程度最小。 由Kt可表示反应的完全程度,判断滴定的可行性

4、水解反应NH,+H,O = NH++OH酸碱解离反应K,=[NH][OH ]/[NH,]Cr3++2 H,O= Cr(OH), +2HK。=[Cr(OH),J[H*]? /[Cr3+]山东翟工大学19HANDONGUNIVTSTOTTCHINOLOGAnalytical Chemistry
Analytical Chemistry 19 4、水解反应 酸碱解离反应

5.1.3溶液中的其他相关平衡明确几个基本概念:1、酸度:溶液的氢离子浓度,也用pH表示,2、碱度:溶液的氢氧根离子浓度,或pOH。3、分析浓度:溶液中某种物质或组分的总浓度,又叫标签浓度,用c表示。4、平衡浓度:平衡体系中实际存在的某种型体的浓度用()表示。例如:0.1mol/LHCl、HAc溶液(H+】 =0.1 mol/LHCI:c=0.1 mol/L,(H+ #0.1 mol/LHAc : c-0.1 mol/L,(HAc】 #0.1 mol/L山东翟工大学20HANDONGUNIVTSTOTICINOLAnalytical Chemistry
Analytical Chemistry 20 明确几个基本概念 : 1、酸度:溶液的氢离子浓度,也用pH表示。 2、碱度:溶液的氢氧根离子浓度,或pOH。 3、分析浓度:溶液中某种物质或组分的总浓度,又叫标 签浓度,用c表示。 4、平衡浓度:平衡体系中实际存在的某种型体的浓度, 用〔 〕表示。 例如:0.1mol/LHCl、HAc溶液 HCl: c=0.1 mol/L, 〔H+ 〕 =0.1 mol/L HAc : c=0.1 mol/L, 〔H+ 〕≠0.1 mol/L 〔HAc 〕≠0.1 mol/L 溶液中的其他相关平衡