
第四章化学平衡Chapter 4 ChemicalEquilibriumS4.1化学反应的方向和限度一、化学反应的限度二、反应系统的Gibbs自由能三、化学反应的平衡常数和等温方程
1 §4.1 化学反应的方向和限度 一、化学反应的限度 二、反应系统的Gibbs 自由能 三、化学反应的平衡常数和等温方程 第四章 化学平衡 Chapter 4 Chemical Equilibrium

AnB一、化学反应的限度forwardProducts反应:Reactantsbackward当反应达到平衡态时,具有下列特征:1.系统中各物质的数量不再随时间而改变。即反应进度达到极限值一el(反应的限度)。2.宏观上看反应停止了,实际上达到动态平衡。rate(forward)=rate(backward)3.平衡不受催化剂的影响4.反应条件不仅能影响平衡,还能改变反应方向如:加压能使石墨一→金刚石2
2 一、化学反应的限度 反应: Reactants Products 当反应达到平衡态时,具有下列特征: 1.系统中各物质的数量不再随时间而改变。即反应 进度达到极限值— eq(反应的限度)。 2.宏观上看反应停止了,实际上达到动态平衡。 rate(forward)= rate(backward) 3.平衡不受催化剂的影响 4.反应条件不仅能影响平衡,还能改变反应方向。 如:加压能使石墨→金刚石 forward backward , 0 d e f B B B B B n n n − = =

二、反应系统的Gibbs自由能任意化学反应:()rp,W"=0时,反应方向和限度的判据为:(dG)T=μdn=VBd≤ 0其中d为反应的进度。d=dnB/VB【<0正向自发;aG=EVBHB7=0平衡;上式可整理为E)T,p>0逆向自发反应系统的吉布斯自由能G如何随=变化呢?3
3 二、反应系统的Gibbs 自由能 , B B T p G = 反应系统的吉布斯自由能G 如何随 变化呢 ? 任意化学反应:( )T, p , W’=0时, 反应方向和限 度的判据为: (dG)T, p = B dnB = B B d 0 其中 d 为反应的进度。 d =dnB /vB 上式可整理为 <0 正向自发; =0 平衡; >0 逆向自发
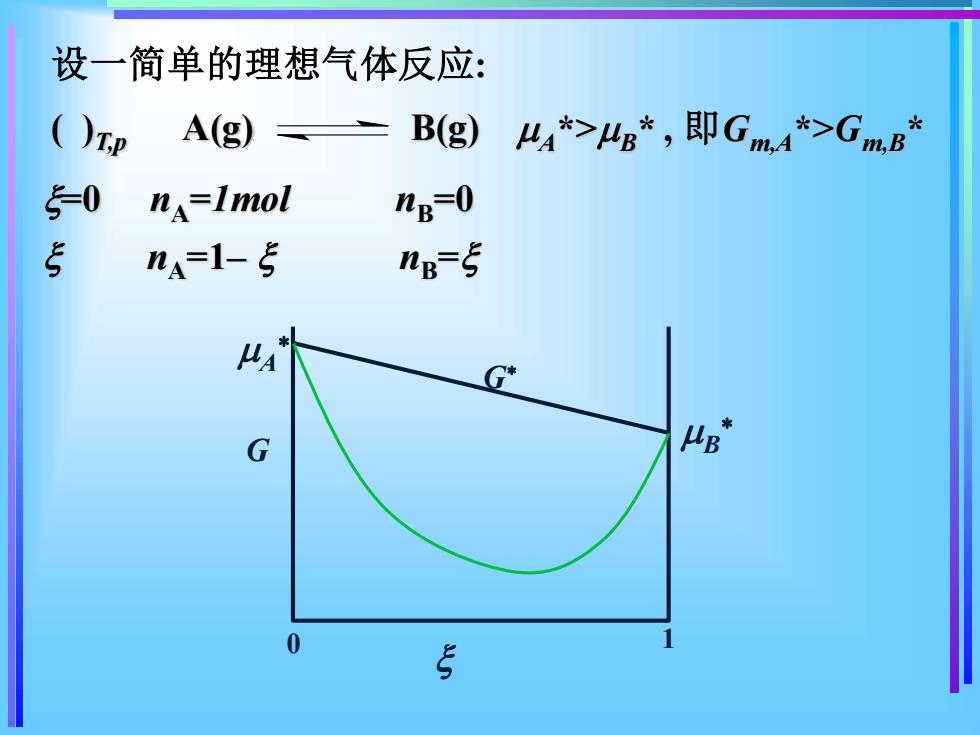
设一简单的理想气体反应:光A(g) B(g)UA*>μB*,即GmA*>G()T,p5m.Am.B5-0np=0n =lmolSn=sna=1- MAUBG0HS
设一简单的理想气体反应: =0 nA =1mol nB=0 nA=1– nB = ( )T,p A(g) B(g) A *>B * , 即Gm,A*>Gm,B * G G 0 1 A B
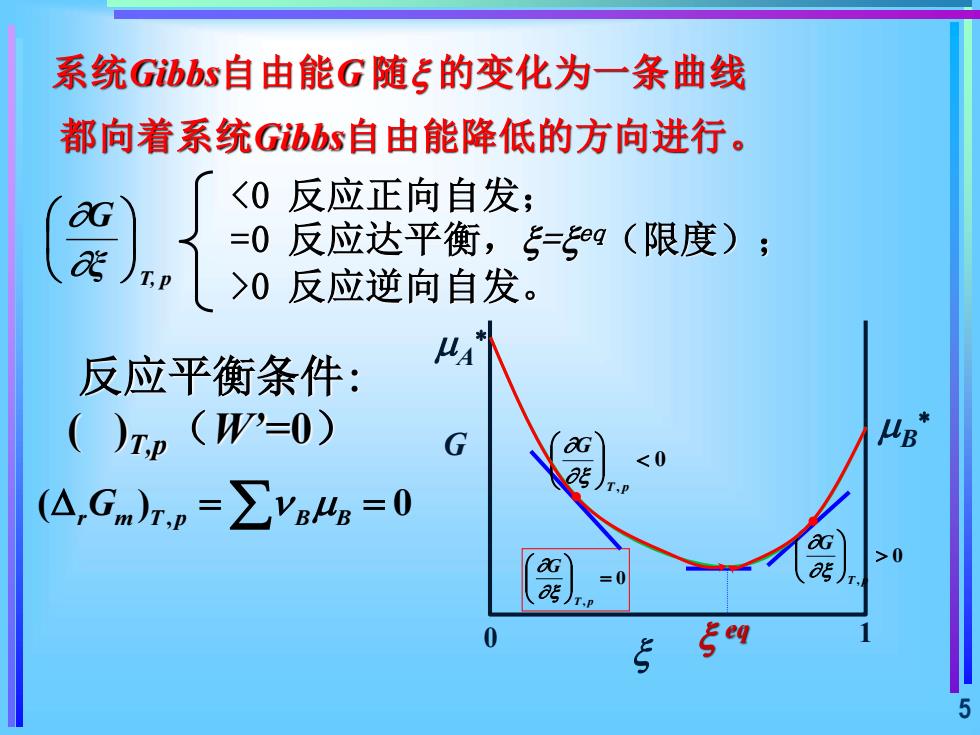
系统Gibbs自由能G随=的变化为一条曲线都向着系统Gibbs自由能降低的方向进行。<0反应正向自发;OG=0反应达平衡,=eq(限度);aTP>0反应逆向自发。美A反应平衡条件:( )Tp (W'=0)μBGaG<0aJT.P(A,Gm)r, =ZVBHg = 0aG>0aGas0=aseqS5
5 反应平衡条件: ( )T,p(W’=0) T, p ξ G , ( ) 0 = = r m T p B B G 系统Gibbs自由能G 随 的变化为一条曲线 都向着系统Gibbs自由能降低的方向进行。 <0 反应正向自发; =0 反应达平衡,= eq(限度); >0 反应逆向自发。 G 0 eq 1 A B 0 , T p G 0 , = T p G 0 , T p G