
发生正偏差或负偏差。如图6一4所示。 偏离比尔定律的因素主要有: 被测溶液浓度过大 比尔定律只适用于测定稀溶液,在浓度高时由于产生吸收的组 分中粒子密度变大,以致每个粒子都可以影响邻近粒子的电荷分布,这种粒子间的相互作用, 使吸收辐射的能力发生了改变,以致发生偏离。 2.化学偏离由于吸收组分的缔合、解离、光化学作用或与溶剂的相互作用,使吸收 峰的形状、位置、强度以及精细结构都发生变化,导致偏离 杂光的影可 比尔定律要求被测溶液吸收的光是单色光,但事实上由于分光光度计 的单色器的输出狭缝分离出的光常混有与选定谱带无关的杂光,这种多色光,则导致对比尔 定律的偏离。一般良好的可见紫外分光光度计在全谱域杂光可保持低于0.1%,多数情况下 可以不考虑杂光的影响。但是当被测试样浓度增加或波长接近紫外的短波界限时,则会导致 检测器灵敏度下降,而且使工作曲线弯向横坐标。由表6一2可见,含杂光的比率越高,对 测定灵敏度的影响就愈大 型6-?杂光对哪光度值的影响 实湖吸光度,A 其实收度A P-0.01 P-01 P-1 P-2 0.1000 0.1000 0.0999 0.0989 0.0878 1.000 0.996 0.9961 0.9926 0.9281 2.000 1.996 1.959 1.701 1.526 4.谱带宽度的影响在实际测定样品时,为了保证足够的光强,分光光度计的狭缝必 须保持一定宽度,因此,由出射狭缝投射到被测物质上的光,并不是真正的单色光,而是 个有限宽度的谱带,称为光谱带通。随着光谱带通宽度的增大, 光源谱带增宽,谱带的精细 结构逐渐消失,峰值吸光度降低,工作曲线的斜率也随之降低,从而偏离比尔定律。 5.其它因素的影响除上述主要因素外,试样中含有悬浮率或胶粒,以及会产生荧光 的物质都会使透射光强度减少而偏离比尔定律。 (四)结察度与检出限 1.精密废可见及紫外分光光度计产生误差的主要来源,在于吸光度的测量误差 根据比尔定律公式 log=sbe 可以改写为 -logT=sbc (6-4) 公式(6一4)等式左边换成自然对数,然后两边取微分,可得: 0.434 dT=sbdc (6-5) T 上述公式(6-4),(6-5)两式相除,经过整理可得下式 dc=0.434 (6-6) 如以有限值表示又可以写成
发生正偏差或负偏差。如图 6-4 所示。 偏离比尔定律的因素主要有: 1.被测溶液浓度过大 比尔定律只适用于测定稀溶液,在浓度高时由于产生吸收的组 分中粒子密度变大,以致每个粒子都可以影响邻近粒子的电荷分布,这种粒子间的相互作用, 使吸收辐射的能力发生了改变,以致发生偏离。 2.化学偏离 由于吸收组分的缔合、解离、光化学作用或与溶剂的相互作用,使吸收 峰的形状、位置、强度以及精细结构都发生变化,导致偏离。 3.杂光的影响 比尔定律要求被测溶液吸收的光是单色光,但事实上由于分光光度计 的单色器的输出狭缝分离出的光常混有与选定谱带无关的杂光,这种多色光,则导致对比尔 定律的偏离。一般良好的可见紫外分光光度计在全谱域杂光可保持低于 0.1%,多数情况下 可以不考虑杂光的影响。但是当被测试样浓度增加或波长接近紫外的短波界限时,则会导致 检测器灵敏度下降,而且使工作曲线弯向横坐标。由表 6-2 可见,含杂光的比率越高,对 测定灵敏度的影响就愈大。 4.谱带宽度的影响 在实际测定样品时,为了保证足够的光强,分光光度计的狭缝必 须保持一定宽度,因此,由出射狭缝投射到被测物质上的光,并不是真正的单色光,而是一 个有限宽度的谱带,称为光谱带通。随着光谱带通宽度的增大,光源谱带增宽,谱带的精细 结构逐渐消失,峰值吸光度降低,工作曲线的斜率也随之降低,从而偏离比尔定律。 5.其它因素的影响 除上述主要因素外,试样中含有悬浮率或胶粒,以及会产生荧光 的物质都会使透射光强度减少而偏离比尔定律。 (四)精密度与检出限 1.精密废 可见及紫外分光光度计产生误差的主要来源,在于吸光度的测量误差。 根据比尔定律公式 1 log T =bc 可以改写为 -log T=bc (6-4) 公式(6-4)等式左边换成自然对数,然后两边取微分,可得: dT d T b c 0.434 - = (6-5) 上述公式(6-4),(6-5)两式相除,经过整理可得下式: d 0.434 dT T log T c c = (6-6) 如以有限值表示又可以写成
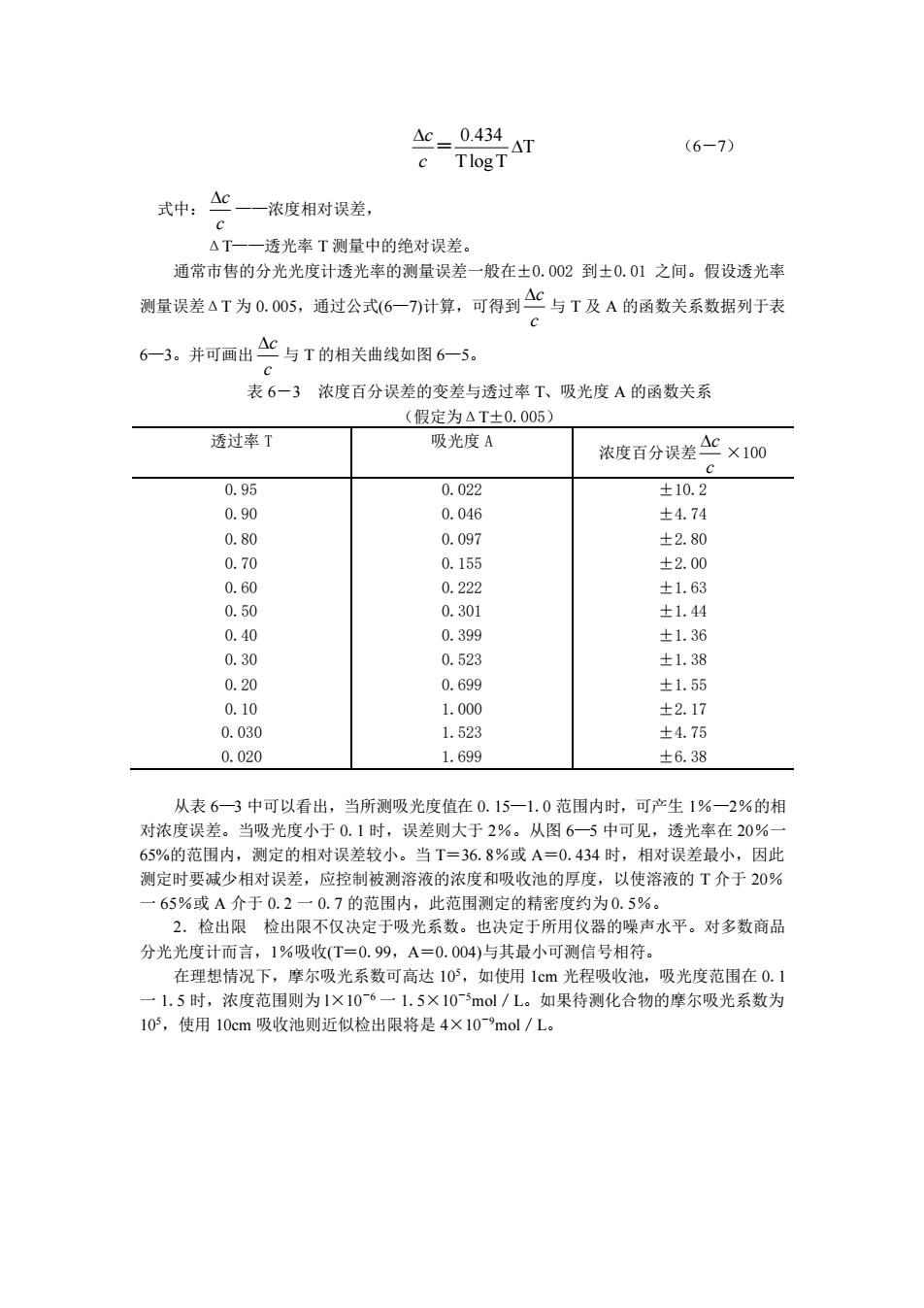
名n (6-7) 式中:C一浓度相对误差, △T一一透光率T测量中的绝对误差。 通常市售的分光光度计透光率的测量误差一般在士0.002到±0.01之间。假设透光率 测量误差△T为0.05,通过公式6一7)计算,可得到C与T及A的函数关系数据列于表 6一3。并可画出△C与T的相关曲线如图6一5。 表6一3浓度百分误差的变差与透过率T、吸光度A的函数关系 (假定为4T±0.005) 透过率了 吸光度A 浓度百分误差4c×10 c 0.95 0.022 ±10.2 0.90 0.046 ±4.74 0.80 0.097 ±2.80 0.70 0.15 ±2.00 0.60 0.222 ±1.63 0.50 0.301 +1.44 0.40 0.399 ±1.36 0.30 0.52% +1.38 0.20 0.699 ±1.5 0.10 1.000 ±2.17 0.030 1.523 ±4.75 0.020 1.699 ±6.38 从表6一3中可以看出, 当所测吸光度值在0.15一1.0范围内时,可产生1%一2%的相 对浓度误差。当吸光度小于0.1时,误差则大于2%。从图6一5中可见,透光率在20% 65%的范围内,测定的相对误差较小。当T=36.8%或A=0.434时,相对误差最小,因此 测定时要减少相对误差,应控制被测溶液的浓度和吸收池的厚度,以使溶液的T介于20% 一65%成A介于0.2一0.7的范围内,出此范围测定的拮密度约为0.5%。 2.检出限检出限不仅决定于吸光系数。也决定于所用仪器的噪声水平。对多数商品 分光光度计而言,1%吸收(T=0.99,A=0.004)与其最小可测信号相符。 在理想情况下,摩尔吸光系数可高达105,如使用1cm光程吸收池,吸光度范围在0.1 一1.5时,浓度范围则为1×106一1.5×10mol/L。如果待测化合物的摩尔吸光系数为 10,使用10cm吸收池则近似检出限将是4X109mol/L
0.434 T T log T c c = (6-7) 式中: c c ——浓度相对误差, ΔT——透光率 T 测量中的绝对误差。 通常市售的分光光度计透光率的测量误差一般在±0.002 到±0.01 之间。假设透光率 测量误差ΔT 为 0.005,通过公式(6—7)计算,可得到 c c 与 T 及 A 的函数关系数据列于表 6—3。并可画出 c c 与 T 的相关曲线如图 6—5。 表 6-3 浓度百分误差的变差与透过率 T、吸光度 A 的函数关系 (假定为ΔT±0.005) 透过率 T 吸光度 A 浓度百分误差 c c ×100 0.95 0.90 0.80 0.70 0.60 0.50 0.40 0.30 0.20 0.10 0.030 0.020 0.022 0.046 0.097 0.155 0.222 0.301 0.399 0.523 0.699 1.000 1.523 1.699 ±10.2 ±4.74 ±2.80 ±2.00 ±1.63 ±1.44 ±1.36 ±1.38 ±1.55 ±2.17 ±4.75 ±6.38 从表 6—3 中可以看出,当所测吸光度值在 0.15—1.0 范围内时,可产生 1%—2%的相 对浓度误差。当吸光度小于 0.1 时,误差则大于 2%。从图 6—5 中可见,透光率在 20%一 65%的范围内,测定的相对误差较小。当 T=36.8%或 A=0.434 时,相对误差最小,因此 测定时要减少相对误差,应控制被测溶液的浓度和吸收池的厚度,以使溶液的 T 介于 20% 一 65%或 A 介于 0.2 一 0.7 的范围内,此范围测定的精密度约为 0.5%。 2.检出限 检出限不仅决定于吸光系数。也决定于所用仪器的噪声水平。对多数商品 分光光度计而言,1%吸收(T=0.99,A=0.004)与其最小可测信号相符。 在理想情况下,摩尔吸光系数可高达 10 5,如使用 1cm 光程吸收池,吸光度范围在 0.1 一 1.5 时,浓度范围则为 l×10-6 一 1.5×10-5mol/L。如果待测化合物的摩尔吸光系数为 105,使用 10cm 吸收池则近似检出限将是 4×10-9mol/L
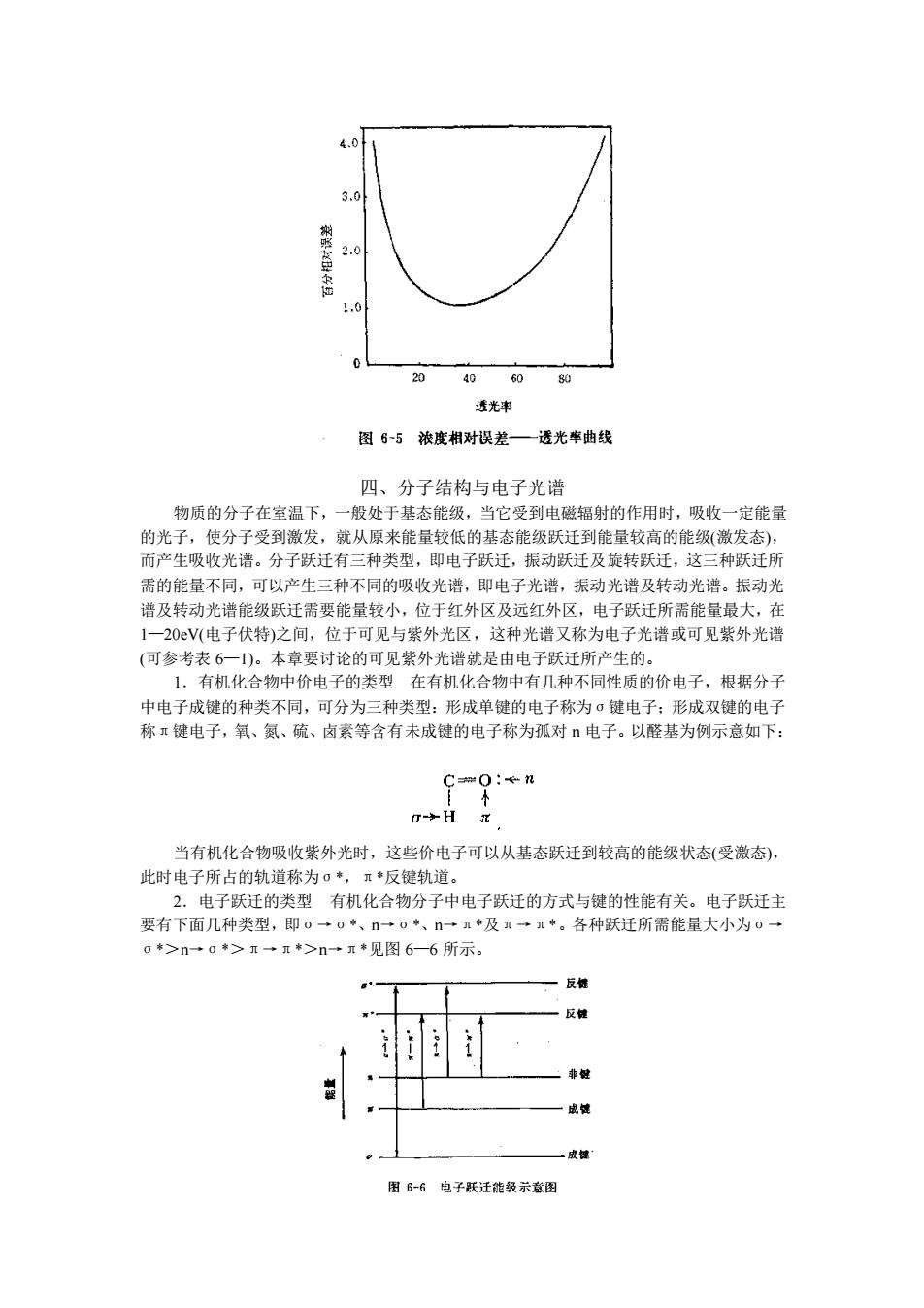
4.0 3 1.0 20 40 60 80 透光事 图6-5浓度相对误差一透光率曲线 四、分子结构与电子光谱 物质的分子在室温下,一般处于基态能级,当它受到电磁辐射的作用时,吸收一定能量 的光子,使分子受到激发,就从原来能量较低的基态能级跃迁到能量较高的能级(激发态) 而产生吸收光谱。分子跃迁有三种类型, 即电子跃迁, 及旋转跃迁,这三种跃迁月 需的能量不同,可以产生三种不同的吸收光谱,即电子光谱,振动光谱及转动光谱。振动光 谱及转动光谱能级跃迁需要能量较小,位于红外区及远红外区,电子跃迁所需能量最大,在 1一20V(电子伏特)之间,位于可见与紫外光区,这种光谱又称为电子光谱或可见紫外光谱 (可参考表6一)。本章要讨论的可见紫外光谱就是由电子跃迁所产生的。 1有机化合物中价电子的类型在有机化合物中有几种不同性质的价电子,根据分了 中电子成键的种类不同,可分为三种类型:形成单键的电子称为σ键电子:形成双键的电手 称π键电子,氧、氨、硫、卤素等含有未成键的电子称为孤对电子。以醛基为例示意如下: 90:en 当有机化合物吸收紫外光时,这些价电子可以从基态跃迁到较高的能级状态(受激态), 此时电子所占的轨道称为。*,π*反键轨道。 2.电子跃迁的类型有机化合物分子中电子跃任的方式与键的性能有关。电子跃任主 要有下面几种类型,即。一0*、n一*、n一◆及算一*。各种跃迁所需能量大小为0一 0>n→>一元*>n一+见图6-6所示。 反 成健 图6-6电子跃迁能级示意图
四、分子结构与电子光谱 物质的分子在室温下,一般处于基态能级,当它受到电磁辐射的作用时,吸收一定能量 的光子,使分子受到激发,就从原来能量较低的基态能级跃迁到能量较高的能级(激发态), 而产生吸收光谱。分子跃迁有三种类型,即电子跃迁,振动跃迁及旋转跃迁,这三种跃迁所 需的能量不同,可以产生三种不同的吸收光谱,即电子光谱,振动光谱及转动光谱。振动光 谱及转动光谱能级跃迁需要能量较小,位于红外区及远红外区,电子跃迁所需能量最大,在 1—20eV(电子伏特)之间,位于可见与紫外光区,这种光谱又称为电子光谱或可见紫外光谱 (可参考表 6—1)。本章要讨论的可见紫外光谱就是由电子跃迁所产生的。 1.有机化合物中价电子的类型 在有机化合物中有几种不同性质的价电子,根据分子 中电子成键的种类不同,可分为三种类型:形成单键的电子称为σ键电子;形成双键的电子 称π键电子,氧、氮、硫、卤素等含有未成键的电子称为孤对 n 电子。以醛基为例示意如下: 当有机化合物吸收紫外光时,这些价电子可以从基态跃迁到较高的能级状态(受激态), 此时电子所占的轨道称为σ*,π*反键轨道。 2.电子跃迁的类型 有机化合物分子中电子跃迁的方式与键的性能有关。电子跃迁主 要有下面几种类型,即σ→σ*、n→σ*、n→π*及π→π*。各种跃迁所需能量大小为σ→ σ*>n→σ*>π→π*>n→π*见图 6—6 所示
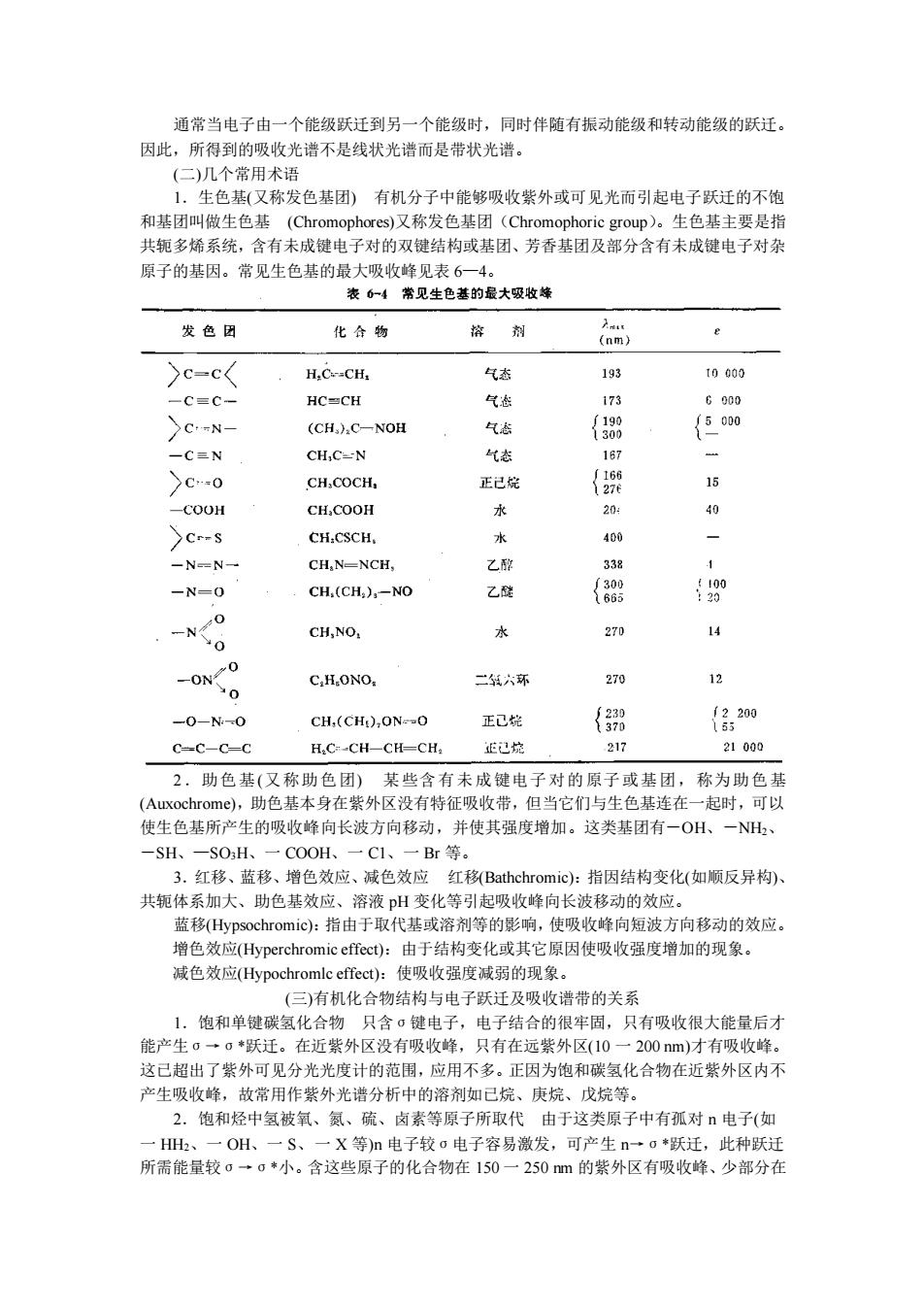
通常当电子由一个能级跃迁到另一个能级时,同时伴随有振动能级和转动能级的跃迁。 因此,所得到的吸收光谱不是线状光谱而是带状光谱。 生色基(又称发色基团)有机分子中能够吸收紫外或可见光而引起电子跃迁的不饱 和基团叫做生色基(Chromophores)又称发色基团(Chromophoric group)。生色基主要是指 共轭多烯系统,含有未成键电子对的双键结构或基团、芳香基团及部分含有未成键电子对杂 原子的基因。常见生色基的最大吸收峰贝表6一4 表6一4常见生色基的最大吸收蜂 发色团 化合物 格剂 e )c-c< H.C.-CH 气数 t0000 -C三C- HC≌CH 气翻 173 G000 CN- (CH.)C-NOH 气志 {388 {5000 一C三N CHC-N 气态 16月 >C0 CH.COCH, 正己烷 {9 15 -COOH CH,COOH 水 204 % Cr-s CH.CSCH. 水 400 -N-N- CH,N-NCH, 乙配 -N=0 CH(CH,)-NO 乙醚 { 00 CH,NO. 水 270 0 -ON C.HONO 二六环 270 名 -0-N-O CH,(CH),ONO 正己皖 {3测 {620 C-C-C-C H.C-CH-CH-CH, 正已控 217 21000 2,助色基(又称助色团)某些含有未成键电子对的原子或基团,称为助色基 ),助色基本身在紫外区没有特征吸收带,但当它们与生色基连在一起时,可以 使生色基所产生的吸收峰向长波方向移动, 并使其强度增加。 这类基团有 OH, -SH、 -SOH、 COOH. 一Br等。 3.红移、蓝移、增色效应、减色效应红移Bathchromic):指因结构变化(如顺反异构) 共轭体系加大、助色基效应、溶液pH变化等引起吸收峰向长波移动的效应。 蓝移Hypsochromic):指由于取代基或溶剂等的影响,使吸收峰向短波方向移动的效应。 增色效应(ype chromic c):由于结构变化或其它原因使吸收强度增加的现象。 减色效应(Hypochromle effect):使吸收强度减弱的现象 (三)有机化合物结构与电子跃迁及吸收谱带的关系 1.饱和单键碳氢化合物只含σ健电子,电子结合的很牢固,只有吸收很大能量后才 能产生σ一c◆跃迁。在近紫外区没有吸收峰,只有在远紫外区(10一200m)才有吸收峰。 这已超出了紫外可见分光光度计的范围,应用不多。正因为饱和碳氢化合物在近紫外区内不 产生吸收峰,故常用作紫外光谱分 析中的溶剂如已烷、庚烷、 戊烷等 2.饱和烃中氢被氧、氮、硫、卤素等原子所取代由于这类原子中有孤对电子(如 一HH、一OH、一S、一X等)n电子较o电子容易激发,可产生n一o*跃迁,此种跃迁 所需能量较0一。·小。含这些原子的化合物在150一250m的紫外区有吸收峰、少部分在
通常当电子由一个能级跃迁到另一个能级时,同时伴随有振动能级和转动能级的跃迁。 因此,所得到的吸收光谱不是线状光谱而是带状光谱。 (二)几个常用术语 1.生色基(又称发色基团) 有机分子中能够吸收紫外或可见光而引起电子跃迁的不饱 和基团叫做生色基 (Chromophores)又称发色基团(Chromophoric group)。生色基主要是指 共轭多烯系统,含有未成键电子对的双键结构或基团、芳香基团及部分含有未成键电子对杂 原子的基因。常见生色基的最大吸收峰见表 6—4。 2.助色基(又称助色团) 某些含有未成键电子对的原子或基团,称为助色基 (Auxochrome),助色基本身在紫外区没有特征吸收带,但当它们与生色基连在一起时,可以 使生色基所产生的吸收峰向长波方向移动,并使其强度增加。这类基团有-OH、-NH2、 -SH、—SO3H、一 COOH、一 C1、一 Br 等。 3.红移、蓝移、增色效应、减色效应 红移(Bathchromic):指因结构变化(如顺反异构)、 共轭体系加大、助色基效应、溶液 pH 变化等引起吸收峰向长波移动的效应。 蓝移(Hypsochromic):指由于取代基或溶剂等的影响,使吸收峰向短波方向移动的效应。 增色效应(Hyperchromic effect):由于结构变化或其它原因使吸收强度增加的现象。 减色效应(Hypochromlc effect):使吸收强度减弱的现象。 (三)有机化合物结构与电子跃迁及吸收谱带的关系 1.饱和单键碳氢化合物 只含σ键电子,电子结合的很牢固,只有吸收很大能量后才 能产生σ→σ*跃迁。在近紫外区没有吸收峰,只有在远紫外区(10 一 200 nm)才有吸收峰。 这已超出了紫外可见分光光度计的范围,应用不多。正因为饱和碳氢化合物在近紫外区内不 产生吸收峰,故常用作紫外光谱分析中的溶剂如已烷、庚烷、戊烷等。 2.饱和烃中氢被氧、氮、硫、卤素等原子所取代 由于这类原子中有孤对 n 电子(如 一 HH2、一 OH、一 S、一 X 等)n 电子较σ电子容易激发,可产生 n→σ*跃迁,此种跃迁 所需能量较σ→σ*小。含这些原子的化合物在 150 一 250 nm 的紫外区有吸收峰、少部分在
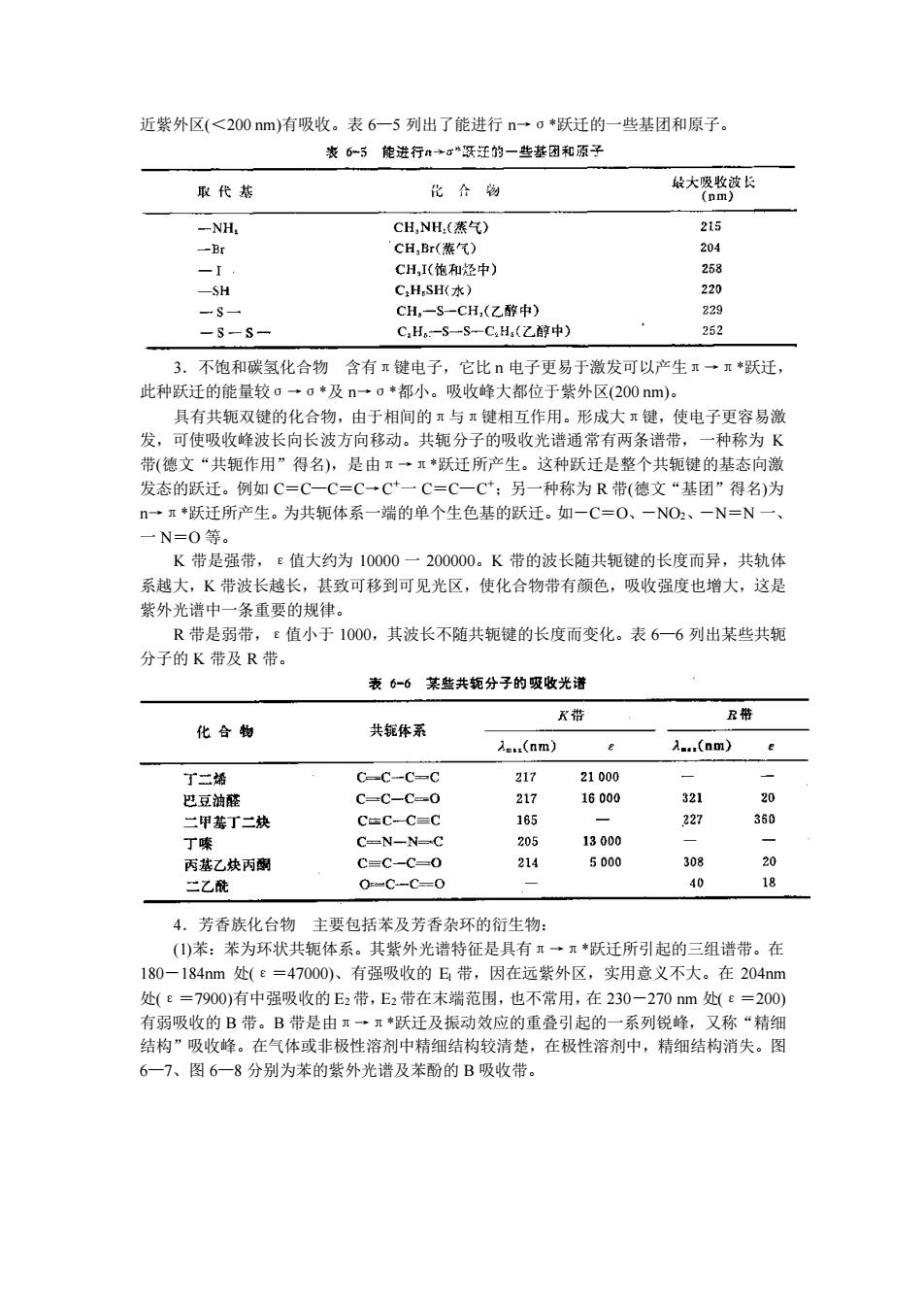
近紫外区(<200nm)有吸收。表6-5列出了能进行n一0*跃迁的一些基团和原子。 表6-5能滋进行→深迁的一些基团和原子 取代恭 化介制 大愿整长 -NH. CH,I(饱和泾中) 253 -SH C,H,SH(水) 220 CH,-S-CH,(乙醇中) 229 -s-S- C,He.-S一S-C,H:(乙醇中) 252 3.不饱和碳氢化合物含有π键电子,它比电子更易于激发可以产生再→π*跃迁, 此种跃迁的能量较g→o◆及n→g*都小。吸收峰大都位于紫外区(200nm)。 具有共双键的化合物, 由于相间的与键相互作用。形成大键 使电子更容易激 发,可使吸收峰波长向长波方向移动。共轭分子的吸收光谱通常有两条谱 种称为】 带(德文“共轭作用”得名),是由→·*跃迁所产生。这种跃迁是整个共轭键的基态向激 发态的跃迁。例如C=C一C=C一C一C=C一C*:另一种称为R带(德文“基团”得名)为 ·π跃迁所产生。为共轭体系一端的单个生色基的跃迁。如一C=O、一NO2、一N=N一 N=O等 K带是强带 值大约为10000一200000。K带的波长随共轭键的长度而异,共轨体 系越大,K带波长越长,甚致可移到可见光区,使化合物带有颜色,吸收强度也增大,这是 紫外光谱中一条重要的规律。 R带是弱带,飞值小于1000,其波长不随共轭键的长度而变化。表6一6列出某些共轭 分子的K带及R带。 表6-6某些共轭分子的吸收光诸 带 R稀 化合物 共钜体系 入.(am) A(nm) 了一场 C-C-CC 217 21000 巴豆油醛 C-C-C-0 217 16000 321 二甲基丁二炔 C=C-C=c 165 227 360 丁嗪 CN一N= 205 13000 丙基乙炔丙副 C=C-C- 214 500( 308 二乙酰 40 4。芳香族化台物主要包括及若香杂环的衍生物 (①)苯:苯为环状共轭体系 。其紫外光谱特征是具有 一*跃迁所引起的三组谱带。在 180一184nm处(e=47000)、有强吸收的E带,因在远紫外区,实用意义不大。在204m 处(E=7900)有中强吸收的E2带,E2带在末端范围,也不常用,在230一270nm处e=200) 有弱吸收的B带。B带是由π→π*跃迁及振动效应的重叠引起的一系列锐峰,又称“精细 结构”吸收峰。在气体或非极性溶剂中精细结构较清楚,在极性溶剂中,精细结构消失。图 6一7、图6一8分别为茶的紫外光谱及苯酚的B吸收带
近紫外区(<200 nm)有吸收。表 6—5 列出了能进行 n→σ*跃迁的一些基团和原子。 3.不饱和碳氢化合物 含有π键电子,它比 n 电子更易于激发可以产生π→π*跃迁, 此种跃迁的能量较σ→σ*及 n→σ*都小。吸收峰大都位于紫外区(200 nm)。 具有共轭双键的化合物,由于相间的π与π键相互作用。形成大π键,使电子更容易激 发,可使吸收峰波长向长波方向移动。共轭分子的吸收光谱通常有两条谱带,一种称为 K 带(德文“共轭作用”得名),是由π→π*跃迁所产生。这种跃迁是整个共轭键的基态向激 发态的跃迁。例如 C=C—C=C→C +一 C=C—C +;另一种称为 R 带(德文“基团”得名)为 n→π*跃迁所产生。为共轭体系一端的单个生色基的跃迁。如-C=O、-NO2、-N=N 一、 一 N=O 等。 K 带是强带,ε值大约为 10000 一 200000。K 带的波长随共轭键的长度而异,共轨体 系越大,K 带波长越长,甚致可移到可见光区,使化合物带有颜色,吸收强度也增大,这是 紫外光谱中一条重要的规律。 R 带是弱带,ε值小于 1000,其波长不随共轭键的长度而变化。表 6—6 列出某些共轭 分子的 K 带及 R 带。 4.芳香族化台物 主要包括苯及芳香杂环的衍生物: (1)苯:苯为环状共轭体系。其紫外光谱特征是具有π→π*跃迁所引起的三组谱带。在 180-184nm 处(ε=47000)、有强吸收的 El 带,因在远紫外区,实用意义不大。在 204nm 处(ε=7900)有中强吸收的 E2 带,E2 带在末端范围,也不常用,在 230-270 nm 处(ε=200) 有弱吸收的 B 带。B 带是由π→π*跃迁及振动效应的重叠引起的一系列锐峰,又称“精细 结构”吸收峰。在气体或非极性溶剂中精细结构较清楚,在极性溶剂中,精细结构消失。图 6—7、图 6—8 分别为苯的紫外光谱及苯酚的 B 吸收带