
:i-C=0+(上C-i0s一:0c=0:·:(=0:+→:0=C-δ: b 上面哪个共振结构最稳定呢?哪个最合理就最稳定。那么判断合理性的标准是什么? ①每个原子外层都具有八隅体的共振结构是更稳定的。a,d,e都有八隅体,而b,c中碳 外层只有六个电子,所以b,c是最不稳定的。 ②电荷分离要最小。d,c(当然b,c也是)的极化结构上的电荷都是分离的(这需要能量 才能完成),所以稳定性a大于d,e。 (③具有电荷分离的共振结构中,那些在电负性元素上有负电荷,电正性元素上有正电荷 的共振结构比那些在电负性元素上有电荷,电正性元素上有负电荷的共振结构要稳定。 例如,甲基异氰酸酯: CH-N=C-:(H,-N-C-0 h 共振结构a比b稳定,因为电负性氧大于氮,当然,最稳定的是CH一N一C=O的共振结 构,因为它没有电荷的分离。 然而似平CO,的共振结构中,(O一C-()比(=(C一()来得稳定,但事实正相反。这是 因为即使后者的正电荷分配在更加电负性的氧上,但它的结构中所有原子都具有八隅体的电 子结构是更重要的。 (3)共振结构的数目越多,因为电子电荷离域作用越大,分子或离子就越稳定。共振杂化 体比任何一个参与的共振结构都要稳定。这种稳定性的增加,称为共振能。即共振结构的数 目越多,共振能越大。例如C有五个共振结构式,它的共振能约为150.5k·mo,故 C)很稳定 (4)参与共振结构的稳定性越接近,则共振能也越大。 例如苯的结构大致可看作a和b的共张杂化体:○一○。因为式a,b非常相像, 稳定性相同,所以苯的共振能也大(150.5k·mol1),苯分子是比较稳定的,常作为溶剂。 虽然在许多场合下,共振论是与事实符合的,但在某些方面也不令人满意。例如下列化合 物如同苯那样有两个完全相同的共振结构式,但它却非常活泼,以致在一般情况下无法把它制 备出来: ☐,C 目前国外教科书与文献中大献使用共振论,主要是因为它采用经典的结构式,比起分子轨 道的表示方法较为清楚简便,容易为有机化学家所接受 1.3.4共价键的属性 为了研究有机分子的性质,除了知道有机分子的化学键是共价键外,还必须研究共价键的 些重要性质一键能、键长、键角和键的极性。这些物理量总称为共价键的“键参数”。根据 11
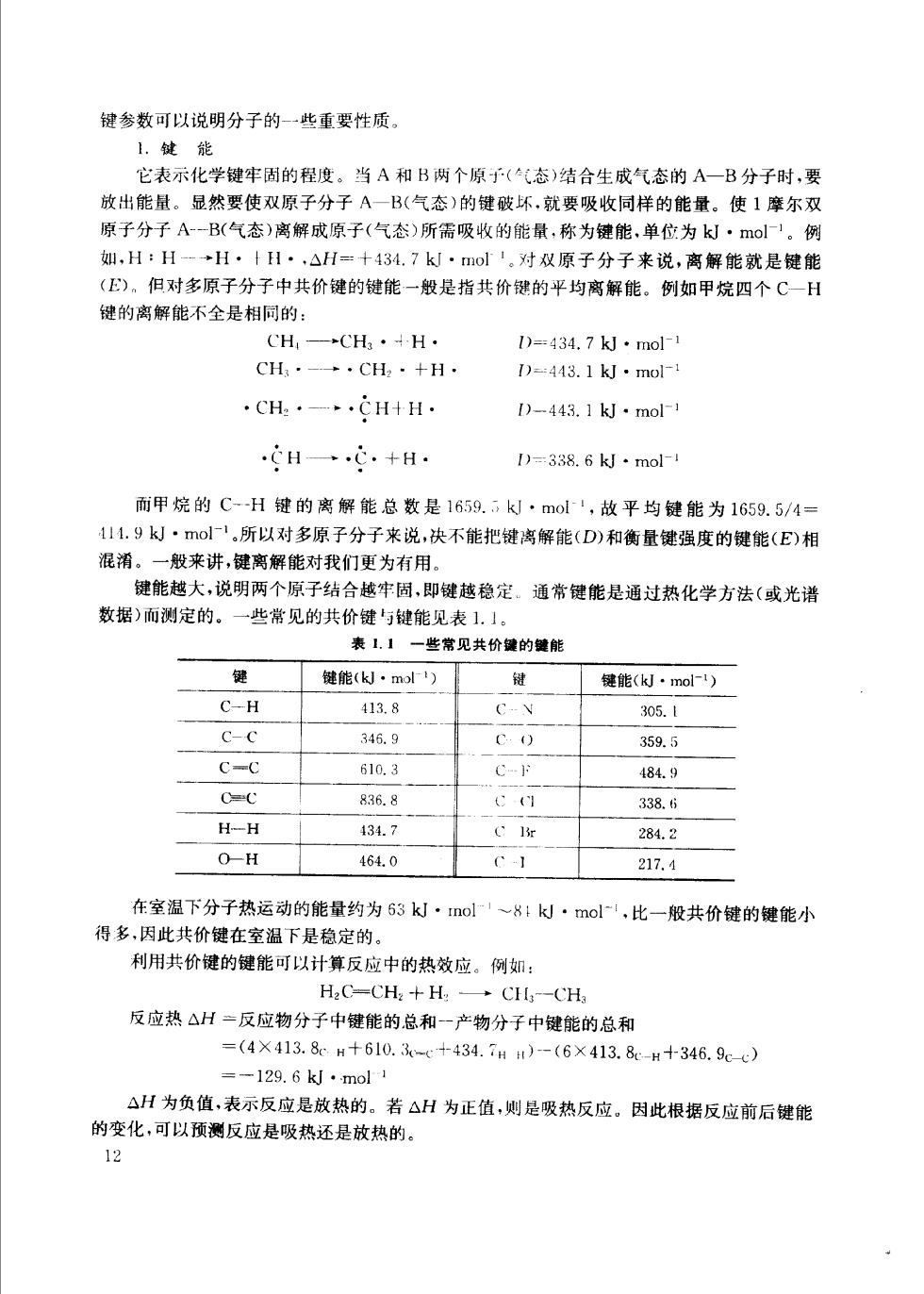
键参数可以说明分子的一些重要性质。 1.键能 它表示化学键牢固的程度。当A和B两个原予(气态)结合生成气态的A一B分子时,要 放出能量。显然要使双原子分子A一B(气态)的键破坏,就要吸收同样的能量。使1摩尔双 原子分子A-一B(气态)离解成原子(气态)所需吸收的能量,称为键能,单位为k·mol。例 如,H:H-→H·卡H·△H=十434.7k·mol'。对双原子分子来说,离解能就是健能 (E)。但对多原子分子中共价键的键能一般是指共价键的平均离解能。例如甲烷四个C一H 键的离解能不全是相同的: CH—CH3·4H· D=434,7kJ·mol1 CH· →·CH2·+H 1)=443.1kJ·mo ·CH2·一~,CH+H. )-443.1kJ·mol HC·+H· )=338.6k·mol 而甲烷的C-H键的离解能总数是1659.k·mol,故平均键能为1659.5/4 111.9k·mol',所以对多原子分子来说,决不能把键离解能(D)和衡量键强度的键能(E)相 混淆。一般来讲,键离解能对我们更为有用」 键能越大,说明两个原子结合越牢固,即键越稳定。通常键能是通过热化学方法(或光谱 数据)而测定的。 一些常见的共价罐'与键能见表】.」 表1】一些常见共价键的健能 健 键能(k·mot) 键 键能(k·mol1) C-H 4138 C-N 305.1 C-C 346.9 C O 359.5 C-C 610.3 C 484.9 836.8 :1 338.6 H-H 434.7 284.2 OH 464.0 217.4 在室温下分子热运动的能量约为53k·tmol1~8:k·mol,比一般共价键的键能小 得多,因此共价键在室温下是稳定的。 利用共价键的键能可以计算反应中的热效应。例如: H2C-CH2+H: →C-CH 反应热△H=反应物分子中键能的总和一产物分子中键能的总和 =(4×413.8H+610.-+434.7H)-(6×413.8-H十346.9-c) =-129.6kJ·mol1 △H为负值,表示反应是放热的。若△H为正值,则是吸热反应。因此根据反应前后键能 的变化,可以预测反应是吸热还是放热的

2.键长 分子中两原子核间的平衡距离叫建长,单位为。一般说来,两个原子之间所形成的键 越短,表示键越强、越牢固。键长往往是通过光谱或衍射等实验方法加以测定。一些常见的共 价键罐长见表1,2 表1.2一些常见的共价镶键长 键 键长(pm) 键长(pm) CH 109 C-V 147 CC 154 -() 143 c-c 134 F 141 C=C 20 (-C1(Br,I)176(194,214) 3.键角 共价键之间的夹角称键角。在甲烷分子中碳原子的键角为10928',但在不同的分子中也 有差异,这是由于分子中原子或基团相互影响所致。例如,丙烷中的C-CH,一C键角不是 10928,而是112。 内烷 键长和键角决定者分子的立体形状,从而可探讨分子的-些性质 4。健的极性 键的极性是由于成键的两原子之间的电负性差异而产生的。当成键的两个原子相同时, 原子双方吸引电子的本领(即电负性)相同,所以共用电子对均匀出现在两个原子之间,也就是 说,电子对恰好在键的中央出现的几率最大。由于两个原子核正电荷所形成的正电荷重心和 分子中负电荷的重心恰好重合,这种键是没有极性的,叫做非极性共价键。例如氢分子中的 HH键,H,C一CH,中的CC键。当成键的两个原子不相同时,电子对则靠近其中电负性 较强的原子一方,正、负电荷重心不重合,这种键叫极性共价键,例如氯甲烷中的 一C键 共价键的极性大小可用偶极矩μ来表示,其大小为以=g·d,?为正,负电荷中心所带的 电荷值(静电单位),d为正、负电荷中心之间的距离(厘米)。因为一个电子带的电荷是4.8× 10静电单位,原子间距离的数量级是10cm,所以偶极矩以的数量级应是10“(厘米·静 电单位)。习惯上把10厘米·静电单位作为偶极矩μ的单位,叫“德拜”(Debye)。即1D= 10~“厘米·静电单位。μ是有方向性的,用+表示。箭头所示的方向是从正电荷到负电荷的 13
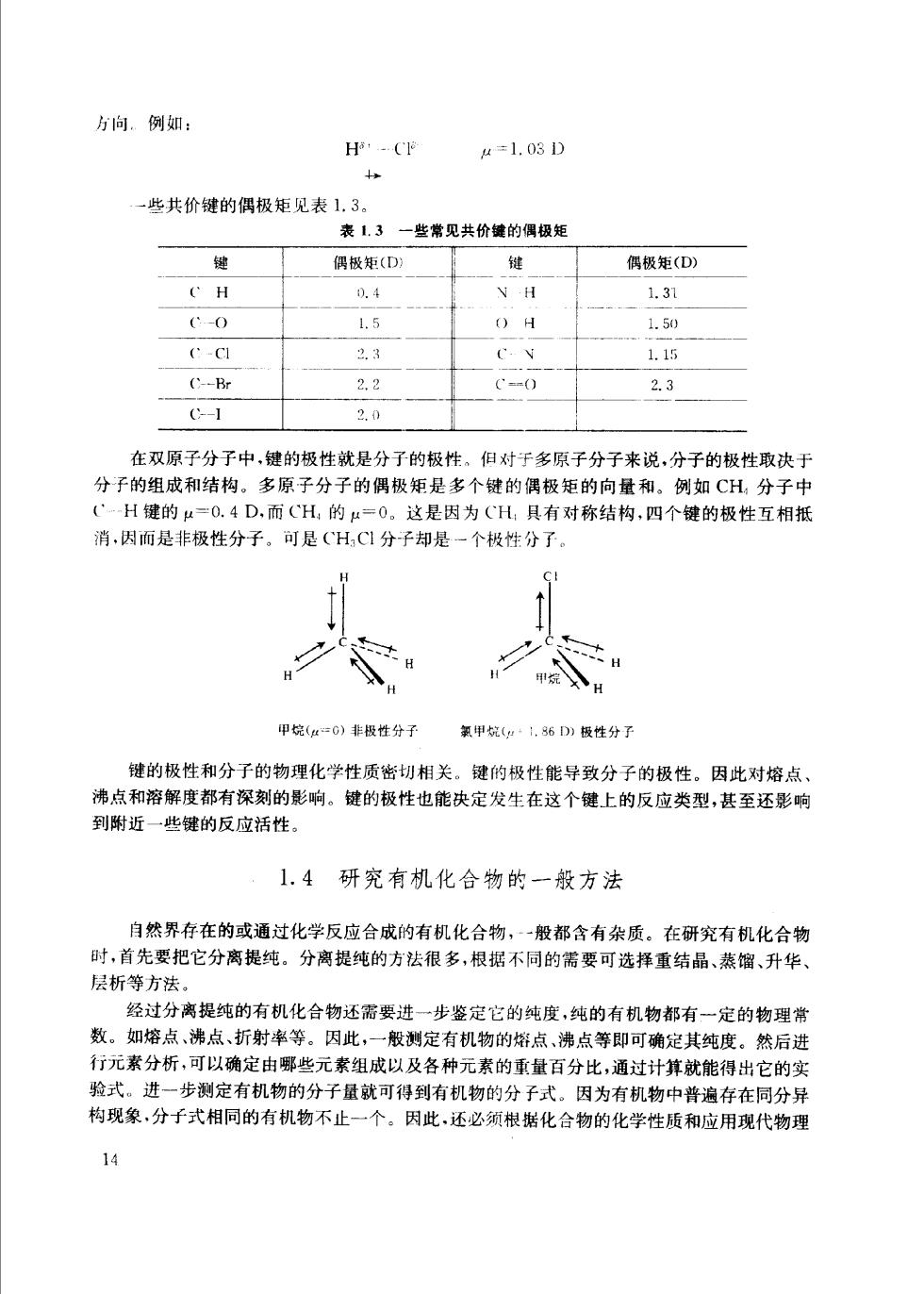
方向。例如: H-CF 4=L.03D 些共价键的偶极矩见表1.3。 表13一些常见共价键的偶极矩 键 偶极矩(D 、雄 偶极矩(D) 0.4 1.31 -0 1.5 1.50 、-C 2.3 1.15 (-Br 2.2 '=n() 2.3 C-1 2.0 在双原子分子中,键的极性就是分子的极性。但对于多原子分子来说,分子的极性取决于 分子的组成和结构。多原子分子的偶极矩是多个键的偶极矩的向量和。例如CH,分子中 CH键的u=0.4D,而CH,的=0。这是因为CH具有对称结构,四个键的极性互相抵 消,因而是非极性分子。可是(CHC1分子却是一个极性分子。 甲烷=G)非极性分子 氯甲烷(·,86D)板性分子 键的极性和分子的物理化学性质密切相关。键的极性能导致分子的极性。因此对熔点 沸点和溶解度都有深刻的影响。键的极性也能决定发生在这个键上的反应类型,甚至还影响 到附近一些键的反应活性。 1.4研究有机化合物的一般方法 自然界存在的或通过化学反应合成的有机化合物,一般都含有杂质。在研究有机化合物 时,首先要把它分离提纯。分离提纯的方法很多,根据不同的需要可选择重结品、蒸馏、升华 层析等方法 经过分离提纯的有机化合物还需要进一步鉴定它的纯度,纯的有机物都有一定的物理常 数。如熔点,沸点、折射率等。因此一般测定有机物的婚点,沸点等即可确定其纯度。然后进 行元素分析,可以确定由哪些元素组成以及各种元素的重量百分比,通过计算就能得出它的实 验式。进一步测定有机物的分子量就可得到有机物的分子式。因为有机物中普遍存在同分异 构现象,分子式相同的有机物不止一个。因此,还必须根据化合物的化学性质和应用现代物理 14

分析方法如X射线分析、电子衍射法、紫外吸收光谱(UV),红外吸收光谱(R)、核磁共振谱 (NMR)和质谱(MS)等来测定有机化合物的分子结构,现代物理分析方法能够准确、快速地 确定有机物的结构,因此在近二三十年来得到广泛应: 我们可以把研究有机化合物的一般方法归纳如下 “纯有机化命物 定性 分析 分 元素组成 量测定 化学分析或现代物理分析方法分析 实验式 ”分子式 官能 分子结构 1.5有机反应的类型 有机反应总的说来可以分为自由基反应(free radical reaction),离子反应(ionic reaction) 和协同反应(concerted reaction)。有机化合物分子中各原子之间的键几平都是共价键,有机 反应的发生必然包含着键的断裂和新键的形成。键的断裂有两种方式:一种方式是成键的一 对电了平均分给两个原子或原子团。倒如。一C:A慧 C十·八。这种断裂方式称为 均裂(homolysis)。均裂生成的带单电子的原子或原子团称为自由基(或游离基),按此方式进 行的反应叫自由基反应。很少的自由基能稳定存在,般在反应中是作为中间体而出现。另 一种方式是成键的一对电子为某一原子或原子团所占有。例如: - 或一C:A生A 这种断裂方式称为异裂(heterolysis),按此方式进行的反应叫离子型反应。异裂生成的 带正电荷的离子或带负电荷的离子分别叫碳正离子(carbocation)和碳负离子(carboanion)。 它们是非常活泼的,在某些反应中仅以中间体形式出现 键的断裂究竟按哪一种方式进行则决定于分子结构和反应条件 一个中性分子异裂为 正、负离子所需的能量较大,比均裂成中性的自由基多400k·mo左右。因此,在气相中 (或在非极性溶剂中的液相反应),在光或高温作用下,键的离解一般按较容易的途径 一均裂 进行。可是在极性溶剂中,或在酸、碱的催化下,反应-一般按异裂的方式进行。从中可以看出 反应条件的重要性。 自1958年以来,在各类反应中都报道有显著的溶剂效应。不同的溶剂往 15