
Lewis酸引 发 F-C反应中的各种金属卤化物,都是电子的接 受体,称为Lewisi酸 从工业角度看,是阳离子聚合最重要的引发剂 0 Lewisi酸包括: 金属卤化物: BF3,AICls,SnCl4,TiCl4,SbCls,PCl5, ZnCl2 金属卤氧化物: POCIs,Cro,CI,SOCl2,VOCls ▣绝大部分Lews酸都需要共(助)引发剂,作为 质子或碳阳离子的供给体
Lewis酸引 发 Lewis酸包括: 金属卤化物: BF3 , AlCl3 , SnCl4 , TiCl4 , SbCl5 , PCl5 , ZnCl2 金属卤氧化物: POCl3,CrO2Cl,SOCl2,VOCl3 绝大部分Lewis酸都需要共(助)引发剂,作为 质子或碳阳离子的供给体 F-C反应中的各种金属卤化物,都是电子的接 受体,称为Lewis酸 从工业角度看,是阳离子聚合最重要的引发剂
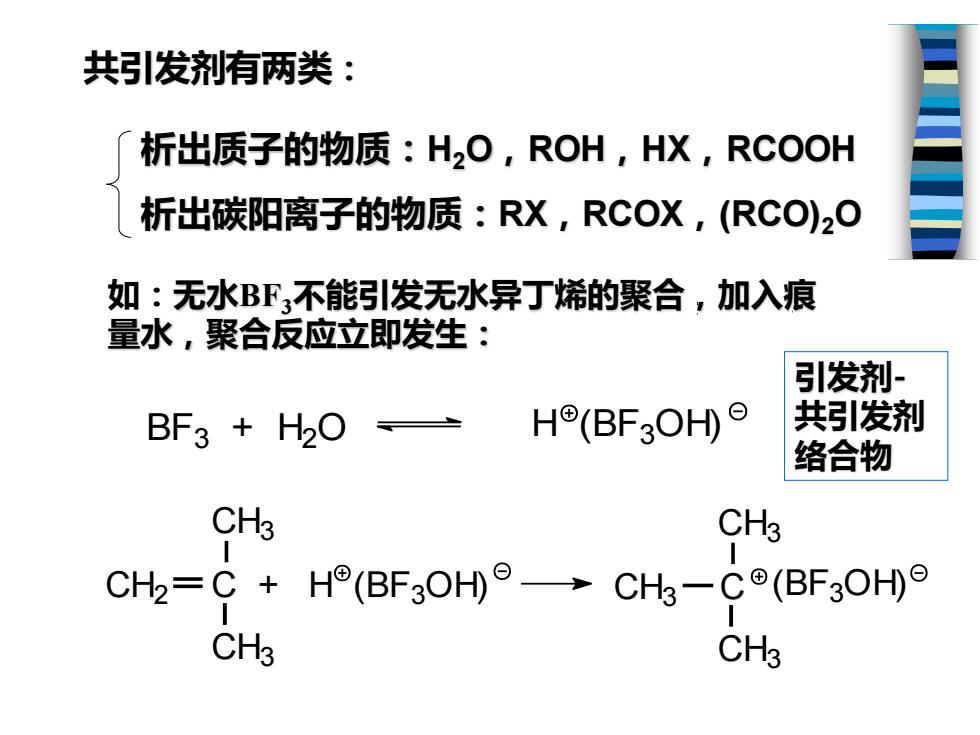
共引发剂有两类: 析出质子的物质:H2O,ROH,HX,RCOOH 析出碳阳离子的物质:RX,RCOX,(RCO)2O 如:无水BF,不能引发无水异丁烯的聚合,加入痕 量水,聚合反应立即发生: 引发剂 BF3 H2O H(BF3OH) 共引发剂 络合物 CH3 CH3 CH2=C+H®(BF3OH°→CH-Co(BF3OHe CH3 CH3
析出质子的物质:H2O,ROH,HX,RCOOH 析出碳阳离子的物质:RX,RCOX,(RCO)2O 如:无水BF3不能引发无水异丁烯的聚合,加入痕 量水,聚合反应立即发生: BF3 + H2 O H (BF3 OH) CH3 CH2 C + CH3 H (BF3 OH) CH3 CH3 C CH3 (BF3 OH) 共引发剂有两类: 引发剂- 共引发剂 络合物

对于析出碳阳离子的情况: SnCl4 RX R(SnCls) CH3 CH3 CH2=C+R(SnCl5))°→R-CH2-Co(SnCl5)e CH3 CHg 引发剂和共引发剂的不同组合,其活性也不同 引发剂的活性与接受电子的能力,即酸性的强弱有关 BF3 AICls TiCl>SnCl4 共引发剂的活性视引发剂不同而不同 如异丁烯聚合,BF3为引发剂,共引发剂的活性: 水:乙酸:甲醇=50:1.5:1
引发剂和共引发剂的不同组合,其活性也不同 引发剂的活性与接受电子的能力, 即酸性的强弱有关 BF3 > AlCl3 > TiCl4 > SnCl4 共引发剂的活性视引发剂不同而不同 如异丁烯聚合,BF3为引发剂,共引发剂的活性: 水 :乙酸 :甲醇= 50 :1. 5 :1 对于析出碳阳离子的情况: SnCl 4 + RX R (SnCl 5) CH3 CH2 C + CH3 R (SnCl 5) CH3 R CH2 C CH3 (SnCl 5)
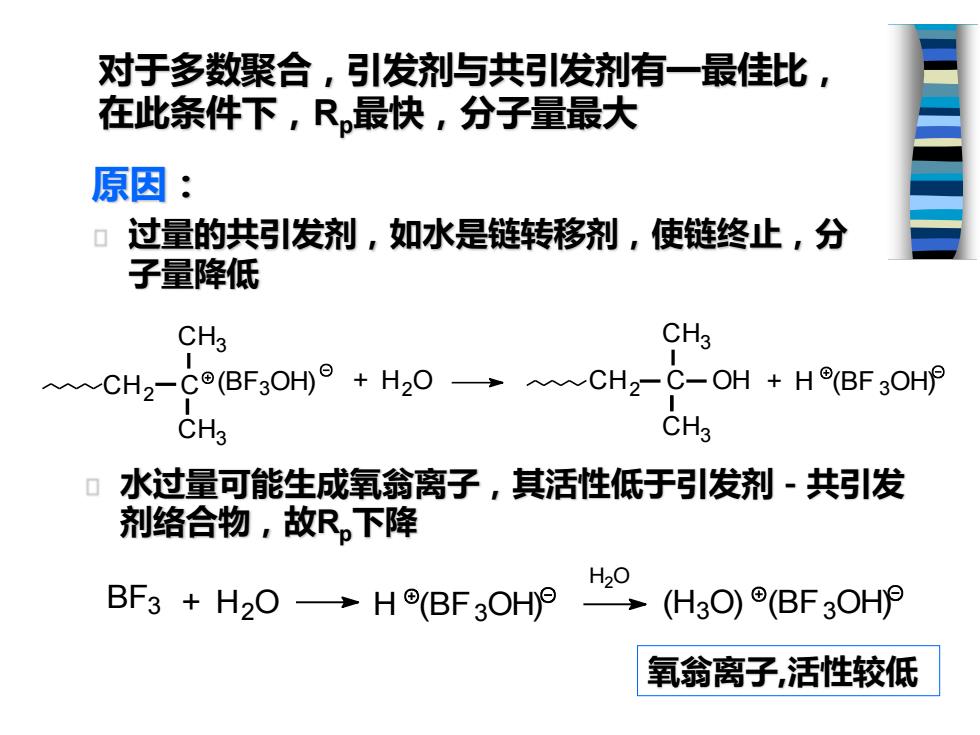
对于多数聚合,引发剂与共引发剂有一最佳比, 在此条件下,R最快,分子量最大 原因: 过量的共引发剂,如水是链转移剂,使链终止,分 子量降低 CHg CHg ~CH2-Co(BF3OH°+H20→CH2-C-OH+HBF3OHP CH3 CHg 0 水过量可能生成氧翁离子,其活性低于引发剂-共引发 剂络合物,故R,下降 H20 BF3+H2O→H(BF3OHP (H3O)(BF3OH 氧翁离子,活性较低
对于多数聚合,引发剂与共引发剂有一最佳比, 在此条件下,Rp最快,分子量最大 水过量可能生成氧翁离子,其活性低于引发剂-共引发 剂络合物,故Rp下降 原因: 过量的共引发剂,如水是链转移剂,使链终止,分 子量降低 (BF3OH) C H3 CH2 C C H3 + H2O + H (BF 3OH) C H3 CH2 C OH C H3 BF3 + H2 O H (BF3OH) H2 O (H3O) (BF3OH) 氧翁离子,活性较低

其它物质引发 其它物质包括:12,高氯酸乙酸酯,氧翁离子 12+2→1(3) 高氯酸乙酸酯可能是通过酰基正离子与单体加成引发 O 0 CH3C(CIO)+M-CHsCM(CIO4) 电离幅射引发,可形成单体阳离子自由基,经偶合形成 双阳离子活性中心. 幅射引发最大特点:碳阳离子活性中心没有反离子存在 电荷转移络合物引发
其它物质引发 其它物质包括:I2,高氯酸乙酸酯,氧翁离子 高氯酸乙酸酯可能是通过酰基正离子与单体加成引发 I 2 + I 2 I (I 3) CH3 C (ClO4) + M O CH3 CM (ClO4) O 电离幅射引发,可形成单体阳离子自由基,经偶合形成 双阳离子活性中心。 幅射引发最大特点:碳阳离子活性中心没有反离子存在 电荷转移络合物引发