
酸碱平衡与酸碱滴定X2. 3共轭酸碱:(1)强电解质的电离:HC1 + H,OH,O+ + Cl二弱酸2弱碱1强酸1强碱2酸性: HCl>H,O碱性: H,O>CI-强酸和强碱作用生成弱酸弱碱的过程,是不可逆过程
HCl + H2O = H3O+ + Cl− 强酸 1 强碱 2 弱酸2 弱碱1 酸性:HCl > H3O+ 碱性:H2O > Cl− 强酸和强碱作用生成弱酸弱碱的过程,是不 可逆过程。 2. 共轭酸碱: (1) 强电解质的电离:

酸碱平衡与酸碱滴定X(2)弱酸、弱碱的电离HAc+ H0 H,O+ + Ac-弱碱2强碱1弱酸1强酸2NH4+ + OH-NH +H0I弱碱1弱酸2强酸2强碱1酸性:HAc<H,O碱性:H,O<Ac碱性:NH,<OH酸性:H,O<NH由弱酸弱碱作用生成强酸强碱的反应,是可逆过程
酸性:HAc < H3O+ 碱性:H2O < Ac− 酸性:H2O < NH4 + 碱性:NH3 < OH− 由弱酸弱碱作用生成强酸强碱的反应,是可逆 过程。 (2) 弱酸、弱碱的电离 HAc + H2O H3O+ + Ac− 弱酸1 弱碱2 强酸2 强碱1 NH3 + H2O NH4+ + OH− 弱碱1 弱酸2 强酸2 强碱1

酸碱平衡与酸碱滴定X(3)j酸碱中和反应二个共轭酸碱对之间的质子传递反应,强碱夺取强酸中的质子,生成更弱的酸及碱的反应如氨与盐酸反应半反应CI- (碱1) +H+HCl (酸1) + H,O(酸2)NH(碱2) +H+ NH+HCI(酸1)+NH3NH4+(酸2)+ C-(碱1)(碱2)共轭
(3)酸碱中和反应 二个共轭酸碱对之间的质子传递反应,强碱夺 取强酸中的质子,生成更弱的酸及碱的反应 如氨与盐酸反应 半反应 HCl(酸1)+ H2O Cl−(碱1)+H+ NH3 (碱2) + H+ NH4 +(酸2) HCl(酸1)+ NH3 (碱2) NH4 +(酸2) + Cl− (碱1) 共轭
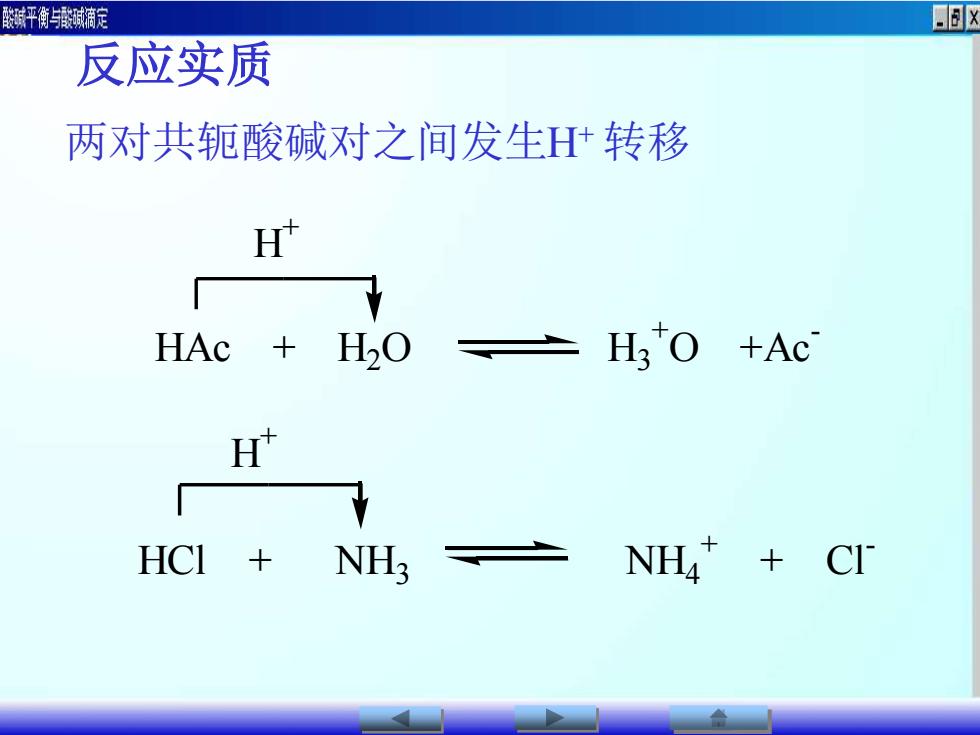
酸碱平衡与酸碱滴定OX.反应实质两对共轭酸碱对之间发生H+转移H*HtoHAc+Ac+H0HtHCI + ClNH4NH3+
反应实质 两对共轭酸碱对之间发生H+ 转移 HAc + H2 O H3 + O +Ac - H + HCl + NH3 NH4 + + Cl - H +

酸碱平衡与酸碱滴定X2酸碱的强弱¥#强弱是相对的,酸越强,其共轭碱越弱,反之亦然OHH,0极弱酸极强碱酸的强度取决于酸将质子转移给水的能力;碱的强度取决于碱从水分子取得质子的能力。*与溶剂有关,HAc在H,O是弱酸,在NH3为强酸酸的强度或碱的强度取决于溶剂接受质子或释放质子的能力
酸碱的强弱 * 强弱是相对的,酸越强,其共轭碱越弱,反之亦然。 极弱酸 极强碱 *与溶剂有关,HAc在 H2O是弱酸,在 NH3为强酸 H2 O OH - 酸的强度取决于酸将质子转移给水的能力;碱的强度取决 于碱从水分子取得质子的能力。 酸的强度或碱的强度取决于溶剂接受质子 或释放质子的能力