
第4章 氧化还原滴定法
第4章 氧化还原滴定法

4.1 氧化还原滴定法概述 氧化还原滴定法是滴定分析中应用最广泛的 方法之一。它是以溶液中氧化剂与还原剂之间的 电子转移为基础的一种滴定分析方法。 • 可以用来进行氧化还原滴定的反应很多。根 据所应用的氧化剂和还原剂,可将氧化还原滴定 法分为:高锰酸钾法、重铬酸钾法、碘量法、铈 量法、溴酸盐法、钒酸盐法等。 • 利用氧化还原法,不仅可以测定具有氧化性 或还原性的物质,而且还可以测定能与氧化剂或 还原剂定量反应形成沉淀的物质。因此,氧化还 原法的应用范围很广泛
4.1 氧化还原滴定法概述 氧化还原滴定法是滴定分析中应用最广泛的 方法之一。它是以溶液中氧化剂与还原剂之间的 电子转移为基础的一种滴定分析方法。 • 可以用来进行氧化还原滴定的反应很多。根 据所应用的氧化剂和还原剂,可将氧化还原滴定 法分为:高锰酸钾法、重铬酸钾法、碘量法、铈 量法、溴酸盐法、钒酸盐法等。 • 利用氧化还原法,不仅可以测定具有氧化性 或还原性的物质,而且还可以测定能与氧化剂或 还原剂定量反应形成沉淀的物质。因此,氧化还 原法的应用范围很广泛

氧化还原反应是基于电子转移的反应, 比较复杂,反应常是分步进行的,需要一 定时间才能完成。因此,必须注意反应速 度,特别是在应用氧化还原反应进行滴定 时,更应注意滴定速度与反应速度相适应。 氧化还原反应,除了发生主反应外。 常常可能发生副反应或因条件不同而生成 不同产物。因此,要考虑创造适当的条件, 使它符合满足分析的基本要求
氧化还原反应是基于电子转移的反应, 比较复杂,反应常是分步进行的,需要一 定时间才能完成。因此,必须注意反应速 度,特别是在应用氧化还原反应进行滴定 时,更应注意滴定速度与反应速度相适应。 氧化还原反应,除了发生主反应外。 常常可能发生副反应或因条件不同而生成 不同产物。因此,要考虑创造适当的条件, 使它符合满足分析的基本要求

4.2电极电势 4.2.1标准电极电势 1原电池:借助氧化还原反应将化学能转变为电能的装置称为原电池。 在CuSO4溶液中放入一片Zn,将发生下列氧化还 原反应: Zn(s) + Cu2+(aq) = Zn2+(aq) + Cu(s) 在溶液中电子直接从Zn片传递给Cu2+,使Cu2+在 Zn片上还原而析出金属Cu,同时Zn氧化为Zn2+ 。 这个反应同时有热量放出,这是化学能转化为热 能的结果
4.2电极电势 4.2.1标准电极电势 1原电池:借助氧化还原反应将化学能转变为电能的装置称为原电池。 在CuSO4溶液中放入一片Zn,将发生下列氧化还 原反应: Zn(s) + Cu2+(aq) = Zn2+(aq) + Cu(s) 在溶液中电子直接从Zn片传递给Cu2+,使Cu2+在 Zn片上还原而析出金属Cu,同时Zn氧化为Zn2+ 。 这个反应同时有热量放出,这是化学能转化为热 能的结果
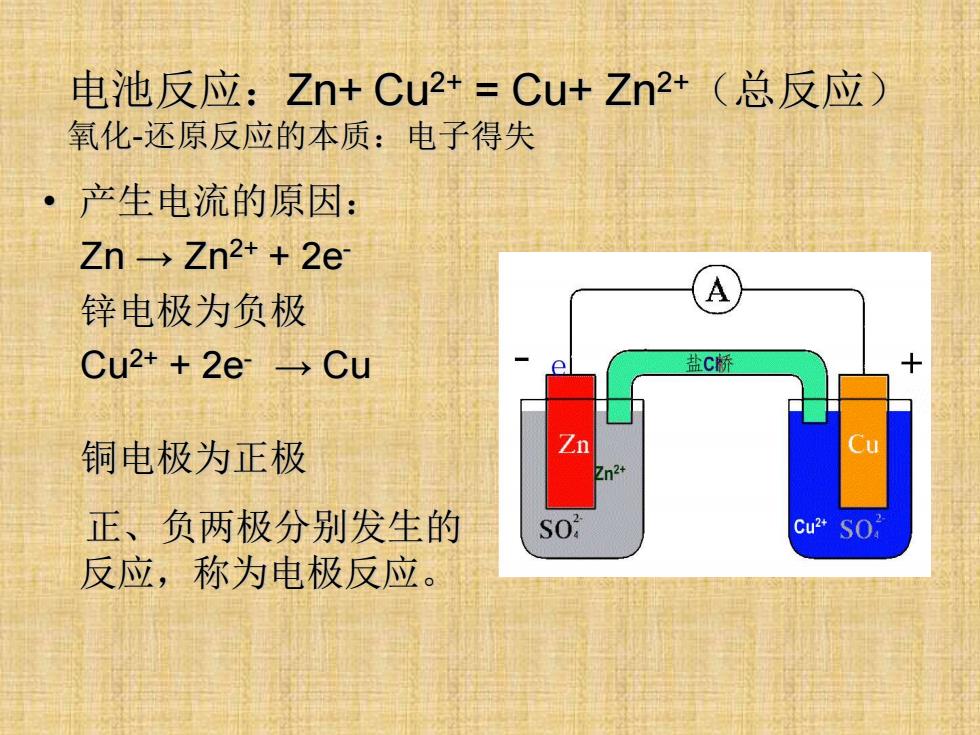
• 产生电流的原因: Zn → Zn2+ + 2e- 锌电极为负极 Cu2+ + 2e- → Cu 铜电极为正极 正、负两极分别发生的 反应,称为电极反应。 电池反应:Zn+ Cu2+ = Cu+ Zn2+(总反应) 氧化-还原反应的本质:电子得失
• 产生电流的原因: Zn → Zn2+ + 2e- 锌电极为负极 Cu2+ + 2e- → Cu 铜电极为正极 正、负两极分别发生的 反应,称为电极反应。 电池反应:Zn+ Cu2+ = Cu+ Zn2+(总反应) 氧化-还原反应的本质:电子得失