
第三节 沉淀法 沉淀法是最古老的分离和纯化生物物质的方法。由于其浓缩作用常大于纯化作 用,因而沉淀法通常作为初步分离的一种方法,用于从去除了菌体或细胞碎片的发 酵液中沉淀出生物物质,然后再利用色层分离等方法进一步提高其纯度。 沉淀法由于成本低、收率高(不会使蛋白质等大分子失活)、浓缩倍数高和操作 简单等优点,是下游加工过程中应用广泛的值得注意的方法。 根据所加入的沉淀剂的不同,沉淀法可以分为:盐析法;等电点沉淀法;有机 溶剂沉淀法;非离子型聚合物沉淀法;聚电解质沉淀法;高价金属离子沉淀法。 一、盐析法 1,盐析的定义 在蛋白质溶液中加入中性盐使其沉淀析出的过程。 2,机理 通过破坏蛋白质分子表面水膜或中和蛋白质分子表面水膜使蛋白质凝聚沉淀。 3,盐析法的优点 成本低,不需要什么特别昂贵的设备;操作简单,安全;对许多生物活性物质 具有稳定作用。 4,盐析法的缺点 沉淀物中含有大量的盐析剂。 5,盐析用中性盐的选择 (1)常用的中性盐 常用的中性盐有 MgSO4、(NH4)2SO4、Na2SO4、NaH2PO4。 (2)选择中性盐应注意的问题 使酶沉淀完全、收率高;且有利于酶的提纯,而本身又易去除。对酶无毒性, 应用不受影响。价格低廉。废水处理容易。 6,盐析剂用量的确定
第三节 沉淀法 沉淀法是最古老的分离和纯化生物物质的方法。由于其浓缩作用常大于纯化作 用,因而沉淀法通常作为初步分离的一种方法,用于从去除了菌体或细胞碎片的发 酵液中沉淀出生物物质,然后再利用色层分离等方法进一步提高其纯度。 沉淀法由于成本低、收率高(不会使蛋白质等大分子失活)、浓缩倍数高和操作 简单等优点,是下游加工过程中应用广泛的值得注意的方法。 根据所加入的沉淀剂的不同,沉淀法可以分为:盐析法;等电点沉淀法;有机 溶剂沉淀法;非离子型聚合物沉淀法;聚电解质沉淀法;高价金属离子沉淀法。 一、盐析法 1,盐析的定义 在蛋白质溶液中加入中性盐使其沉淀析出的过程。 2,机理 通过破坏蛋白质分子表面水膜或中和蛋白质分子表面水膜使蛋白质凝聚沉淀。 3,盐析法的优点 成本低,不需要什么特别昂贵的设备;操作简单,安全;对许多生物活性物质 具有稳定作用。 4,盐析法的缺点 沉淀物中含有大量的盐析剂。 5,盐析用中性盐的选择 (1)常用的中性盐 常用的中性盐有 MgSO4、(NH4)2SO4、Na2SO4、NaH2PO4。 (2)选择中性盐应注意的问题 使酶沉淀完全、收率高;且有利于酶的提纯,而本身又易去除。对酶无毒性, 应用不受影响。价格低廉。废水处理容易。 6,盐析剂用量的确定
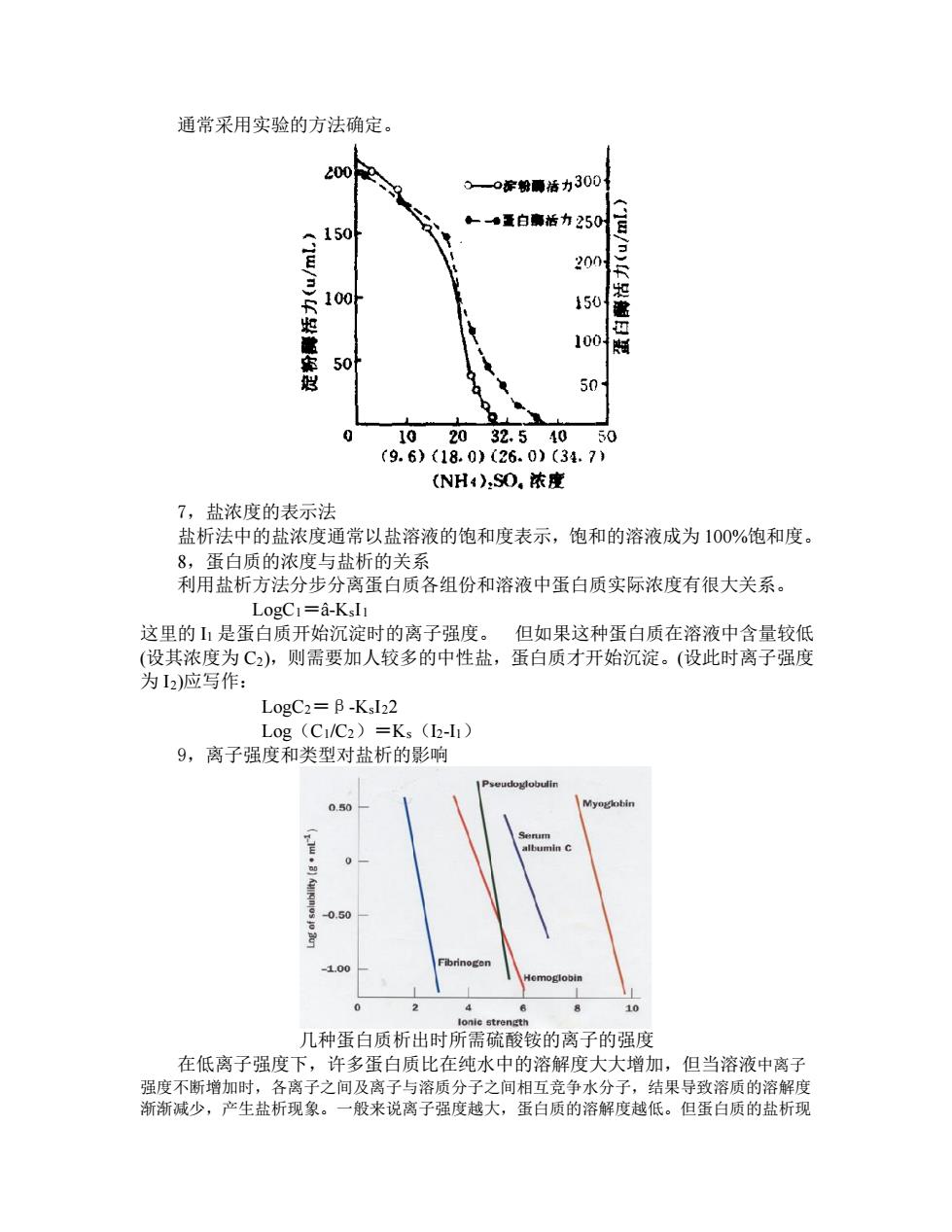
通常采用实验的方法确定。 7,盐浓度的表示法 盐析法中的盐浓度通常以盐溶液的饱和度表示,饱和的溶液成为 100%饱和度。 8,蛋白质的浓度与盐析的关系 利用盐析方法分步分离蛋白质各组份和溶液中蛋白质实际浓度有很大关系。 LogC1=â-KsI1 这里的 I1 是蛋白质开始沉淀时的离子强度。 但如果这种蛋白质在溶液中含量较低 (设其浓度为 C2),则需要加人较多的中性盐,蛋白质才开始沉淀。(设此时离子强度 为 I2)应写作: LogC2=β-KsI22 Log(C1/C2)=Ks(I2-I1) 9,离子强度和类型对盐析的影响 几种蛋白质析出时所需硫酸铵的离子的强度 在低离子强度下,许多蛋白质比在纯水中的溶解度大大增加,但当溶液中离子 强度不断增加时,各离子之间及离子与溶质分子之间相互竞争水分子,结果导致溶质的溶解度 渐渐减少,产生盐析现象。一般来说离子强度越大,蛋白质的溶解度越低。但蛋白质的盐析现
通常采用实验的方法确定。 7,盐浓度的表示法 盐析法中的盐浓度通常以盐溶液的饱和度表示,饱和的溶液成为 100%饱和度。 8,蛋白质的浓度与盐析的关系 利用盐析方法分步分离蛋白质各组份和溶液中蛋白质实际浓度有很大关系。 LogC1=â-KsI1 这里的 I1 是蛋白质开始沉淀时的离子强度。 但如果这种蛋白质在溶液中含量较低 (设其浓度为 C2),则需要加人较多的中性盐,蛋白质才开始沉淀。(设此时离子强度 为 I2)应写作: LogC2=β-KsI22 Log(C1/C2)=Ks(I2-I1) 9,离子强度和类型对盐析的影响 几种蛋白质析出时所需硫酸铵的离子的强度 在低离子强度下,许多蛋白质比在纯水中的溶解度大大增加,但当溶液中离子 强度不断增加时,各离子之间及离子与溶质分子之间相互竞争水分子,结果导致溶质的溶解度 渐渐减少,产生盐析现象。一般来说离子强度越大,蛋白质的溶解度越低。但蛋白质的盐析现
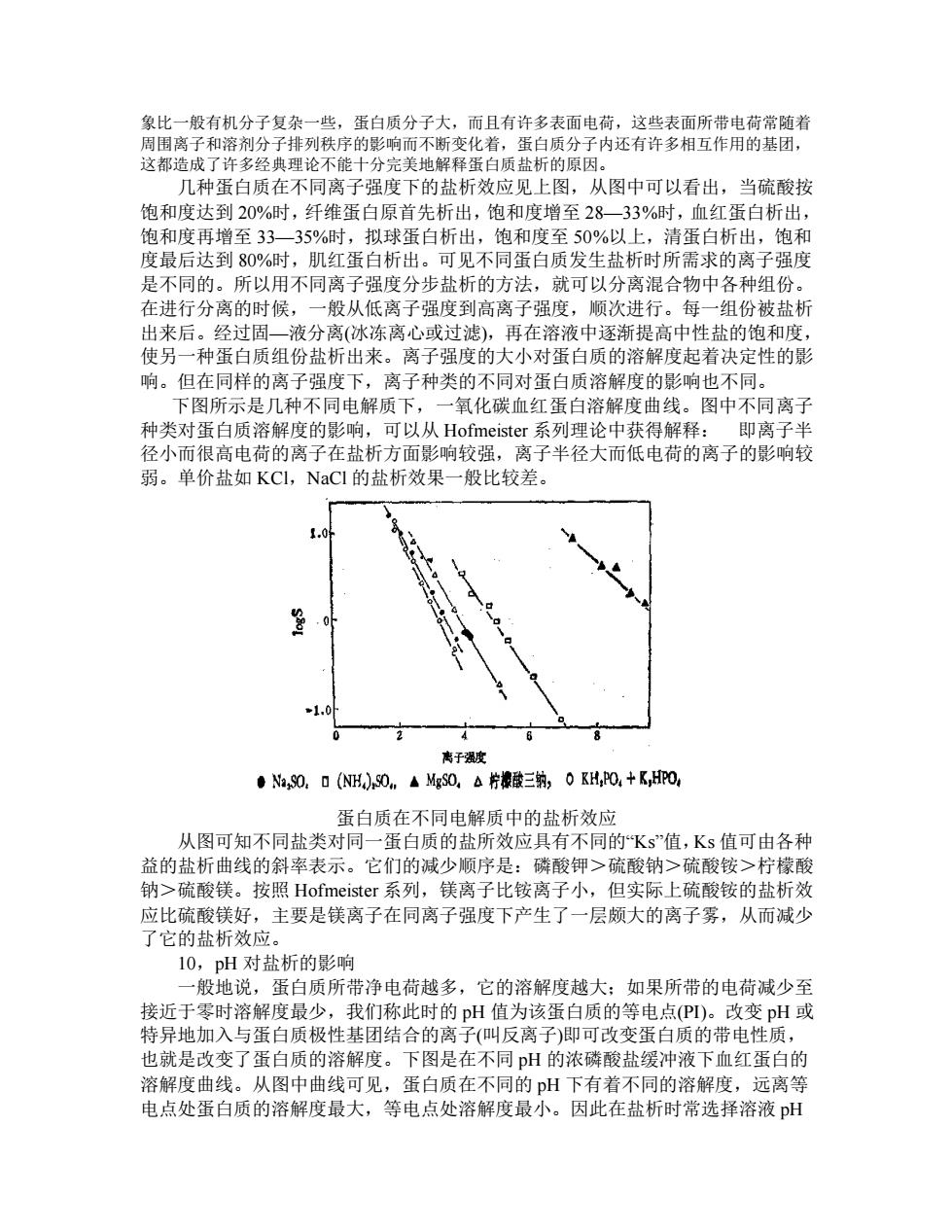
象比一般有机分子复杂一些,蛋白质分子大,而且有许多表面电荷,这些表面所带电荷常随着 周围离子和溶剂分子排列秩序的影响而不断变化着,蛋白质分子内还有许多相互作用的基团, 这都造成了许多经典理论不能十分完美地解释蛋白质盐析的原因。 几种蛋白质在不同离子强度下的盐析效应见上图,从图中可以看出,当硫酸按 饱和度达到 20%时,纤维蛋白原首先析出,饱和度增至 28—33%时,血红蛋白析出, 饱和度再增至 33—35%时,拟球蛋白析出,饱和度至 50%以上,清蛋白析出,饱和 度最后达到 80%时,肌红蛋白析出。可见不同蛋白质发生盐析时所需求的离子强度 是不同的。所以用不同离子强度分步盐析的方法,就可以分离混合物中各种组份。 在进行分离的时候,一般从低离子强度到高离子强度,顺次进行。每一组份被盐析 出来后。经过固—液分离(冰冻离心或过滤),再在溶液中逐渐提高中性盐的饱和度, 使另一种蛋白质组份盐析出来。离子强度的大小对蛋白质的溶解度起着决定性的影 响。但在同样的离子强度下,离子种类的不同对蛋白质溶解度的影响也不同。 下图所示是几种不同电解质下,一氧化碳血红蛋白溶解度曲线。图中不同离子 种类对蛋白质溶解度的影响,可以从 Hofmeister 系列理论中获得解释: 即离子半 径小而很高电荷的离子在盐析方面影响较强,离子半径大而低电荷的离子的影响较 弱。单价盐如 KCl,NaCl 的盐析效果一般比较差。 蛋白质在不同电解质中的盐析效应 从图可知不同盐类对同一蛋白质的盐所效应具有不同的“Ks”值,Ks 值可由各种 益的盐析曲线的斜率表示。它们的减少顺序是:磷酸钾>硫酸钠>硫酸铵>柠檬酸 钠>硫酸镁。按照 Hofmeister 系列,镁离子比铵离子小,但实际上硫酸铵的盐析效 应比硫酸镁好,主要是镁离子在同离子强度下产生了一层颇大的离子雾,从而减少 了它的盐析效应。 10,pH 对盐析的影响 一般地说,蛋白质所带净电荷越多,它的溶解度越大;如果所带的电荷减少至 接近于零时溶解度最少,我们称此时的 pH 值为该蛋白质的等电点(PI)。改变 pH 或 特异地加入与蛋白质极性基团结合的离子(叫反离子)即可改变蛋白质的带电性质, 也就是改变了蛋白质的溶解度。下图是在不同 pH 的浓磷酸盐缓冲液下血红蛋白的 溶解度曲线。从图中曲线可见,蛋白质在不同的 pH 下有着不同的溶解度,远离等 电点处蛋白质的溶解度最大,等电点处溶解度最小。因此在盐析时常选择溶液 pH
象比一般有机分子复杂一些,蛋白质分子大,而且有许多表面电荷,这些表面所带电荷常随着 周围离子和溶剂分子排列秩序的影响而不断变化着,蛋白质分子内还有许多相互作用的基团, 这都造成了许多经典理论不能十分完美地解释蛋白质盐析的原因。 几种蛋白质在不同离子强度下的盐析效应见上图,从图中可以看出,当硫酸按 饱和度达到 20%时,纤维蛋白原首先析出,饱和度增至 28—33%时,血红蛋白析出, 饱和度再增至 33—35%时,拟球蛋白析出,饱和度至 50%以上,清蛋白析出,饱和 度最后达到 80%时,肌红蛋白析出。可见不同蛋白质发生盐析时所需求的离子强度 是不同的。所以用不同离子强度分步盐析的方法,就可以分离混合物中各种组份。 在进行分离的时候,一般从低离子强度到高离子强度,顺次进行。每一组份被盐析 出来后。经过固—液分离(冰冻离心或过滤),再在溶液中逐渐提高中性盐的饱和度, 使另一种蛋白质组份盐析出来。离子强度的大小对蛋白质的溶解度起着决定性的影 响。但在同样的离子强度下,离子种类的不同对蛋白质溶解度的影响也不同。 下图所示是几种不同电解质下,一氧化碳血红蛋白溶解度曲线。图中不同离子 种类对蛋白质溶解度的影响,可以从 Hofmeister 系列理论中获得解释: 即离子半 径小而很高电荷的离子在盐析方面影响较强,离子半径大而低电荷的离子的影响较 弱。单价盐如 KCl,NaCl 的盐析效果一般比较差。 蛋白质在不同电解质中的盐析效应 从图可知不同盐类对同一蛋白质的盐所效应具有不同的“Ks”值,Ks 值可由各种 益的盐析曲线的斜率表示。它们的减少顺序是:磷酸钾>硫酸钠>硫酸铵>柠檬酸 钠>硫酸镁。按照 Hofmeister 系列,镁离子比铵离子小,但实际上硫酸铵的盐析效 应比硫酸镁好,主要是镁离子在同离子强度下产生了一层颇大的离子雾,从而减少 了它的盐析效应。 10,pH 对盐析的影响 一般地说,蛋白质所带净电荷越多,它的溶解度越大;如果所带的电荷减少至 接近于零时溶解度最少,我们称此时的 pH 值为该蛋白质的等电点(PI)。改变 pH 或 特异地加入与蛋白质极性基团结合的离子(叫反离子)即可改变蛋白质的带电性质, 也就是改变了蛋白质的溶解度。下图是在不同 pH 的浓磷酸盐缓冲液下血红蛋白的 溶解度曲线。从图中曲线可见,蛋白质在不同的 pH 下有着不同的溶解度,远离等 电点处蛋白质的溶解度最大,等电点处溶解度最小。因此在盐析时常选择溶液 pH
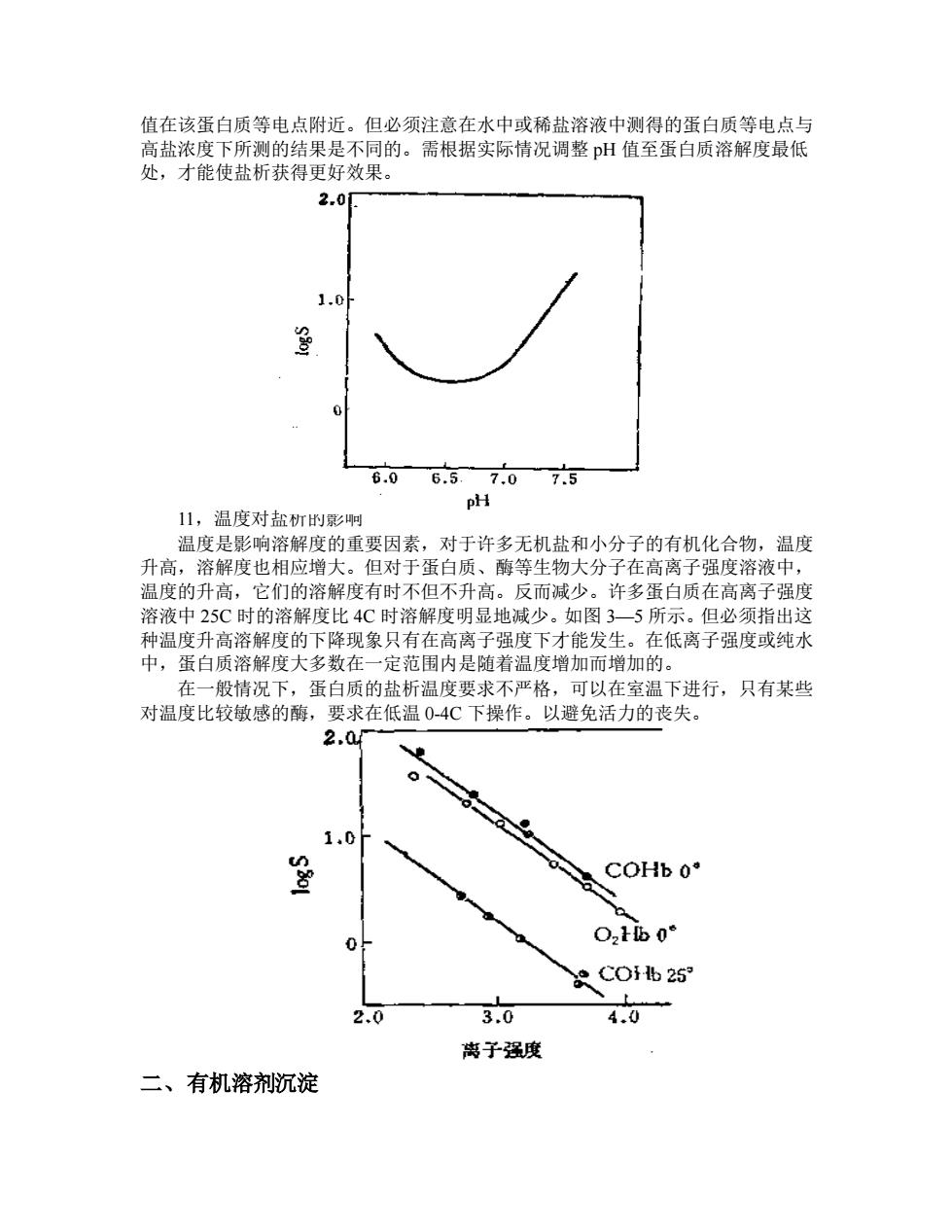
值在该蛋白质等电点附近。但必须注意在水中或稀盐溶液中测得的蛋白质等电点与 高盐浓度下所测的结果是不同的。需根据实际情况调整 pH 值至蛋白质溶解度最低 处,才能使盐析获得更好效果。 11,温度对盐析的影响 温度是影响溶解度的重要因素,对于许多无机盐和小分子的有机化合物,温度 升高,溶解度也相应增大。但对于蛋白质、酶等生物大分子在高离子强度溶液中, 温度的升高,它们的溶解度有时不但不升高。反而减少。许多蛋白质在高离子强度 溶液中 25C 时的溶解度比 4C 时溶解度明显地减少。如图 3—5 所示。但必须指出这 种温度升高溶解度的下降现象只有在高离子强度下才能发生。在低离子强度或纯水 中,蛋白质溶解度大多数在一定范围内是随着温度增加而增加的。 在一般情况下,蛋白质的盐析温度要求不严格,可以在室温下进行,只有某些 对温度比较敏感的酶,要求在低温 0-4C 下操作。以避免活力的丧失。 二、有机溶剂沉淀
值在该蛋白质等电点附近。但必须注意在水中或稀盐溶液中测得的蛋白质等电点与 高盐浓度下所测的结果是不同的。需根据实际情况调整 pH 值至蛋白质溶解度最低 处,才能使盐析获得更好效果。 11,温度对盐析的影响 温度是影响溶解度的重要因素,对于许多无机盐和小分子的有机化合物,温度 升高,溶解度也相应增大。但对于蛋白质、酶等生物大分子在高离子强度溶液中, 温度的升高,它们的溶解度有时不但不升高。反而减少。许多蛋白质在高离子强度 溶液中 25C 时的溶解度比 4C 时溶解度明显地减少。如图 3—5 所示。但必须指出这 种温度升高溶解度的下降现象只有在高离子强度下才能发生。在低离子强度或纯水 中,蛋白质溶解度大多数在一定范围内是随着温度增加而增加的。 在一般情况下,蛋白质的盐析温度要求不严格,可以在室温下进行,只有某些 对温度比较敏感的酶,要求在低温 0-4C 下操作。以避免活力的丧失。 二、有机溶剂沉淀