
山东理工大客SHANDONGUNIVERSITYOFTECHNOLOGY六、动力学处理法dcx.=01.稳态法:中间产物X很活泼,浓度很小dtk.C,B+C kP中间产物C很活泼如Ak.d[C] = k [A] - k.[C] - k,[BI[C] = 0dtd[P]k,k_[A][B]= k,[B][C] k_+k2[B]dt2.平衡浓度法:决速步前后的反应可近似平衡处理如上例,当k,很小时,[C]=(k-/k)[A]k,kr = k,[B][C][ATB]= k[A]B]k- 10-
11 - 10- 六、动力学处理法 1.稳态法:中间产物X很活泼,浓度很小 2.平衡浓度法:决速步前后的反应可近似平衡处理 如上例,当k2很小时,[C]=(k+ /k- )[A] = 0 dt dcX [ ][ ] [ ] k2 B C dt d P r = = [ ] [ ][ ] 2 2 k k B k k A B + = − + 如 中间产物C很活泼 [ ] [ ] [ ][ ] 0 [ ] = k+ A − k− C − k2 B C = dt d C [ ][ ] [ ][ ] [ ][ ] 2 2 A B k A B k k k r = k B C = = − + k2 k+ k- A C, B+C P

山东理工大客SHANDONGUNIVERSITYOFTECHNOLOGY例题(二)例1、选择、填空1.对于反应2NO,=2NO+O,,其反应速率表达式为(D) d[O,]2d[NO,] ,2d[NO1(A)dtdtdtd[0,]ded[NO,]d[NO](B)2dt2dtdtdtd[O,]d[NO]d[NO, ](C)dtdtdtdd[NO]d[O,]d[NO, ](D)2dtdt2dtVdt 11 -
12 - 11 - (二)例题 例1、选择、填空 1.对于反应2NO2=2NO+O2,其反应速率表达式为( ) Vdt d dt d O dt d NO dt d NO D dt d O dt d NO dt d NO C dt d dt d O dt d NO dt d NO B dt d O dt d NO dt d NO A − = = = − = = − = = = − = = [ ] 2 [ ] 2 [ ] ( ) [ ] [ ] [ ] ( ) [ ] 2 [ ] 2 [ ] ( ) 2 [ ] 2 [ ] [ ] ( ) 2 2 2 2 2 2 2 2 D

山东理工大客SHANDONGUNIVERSITYOFTECHNOLOGYdcAkCACB2.反应A+B→C的速率方程为dtCc则该反应的总级数是1 级,的单位S-13.某反应的转化率分别为50%,75%,87.5%,所须时间分别为t1/2,2t1/2,3t1/2,则该反应对此物质的级数为 14.已知某反应的速率方程为r=k[A][Bl,则该反应的级不能确定数为_2,反应分子数3.解: 一级反应kt-ln(co/c), ti/2=ln2/k,t3/4=ln4/k=2ln2/k,tz/8=ln8/k=3ln2/k ,- 12 -
13 - 12 - 2 .反应A + B →C的速率方程为 则该反应的总级数是_级,k的单位_ 3. 某反应的转化率分别为50%,75%,87.5%, 所须 时间分别为t1/2,2t1/2 , 3t1/2 ,则该反应对此物质 的级数为_ C A A B c c c k dt dc − = 1 s -1 1 2 不能确定 3.解:一级反应kt=ln(c0 /c), t1/2=ln2/k, t3/4=ln4/k=2ln2/k, t7/8=ln8/k=3ln2/k , 4. 已知某反应的速率方程为r=k[A][B], 则该反应的级 数为_, 反应分子数_
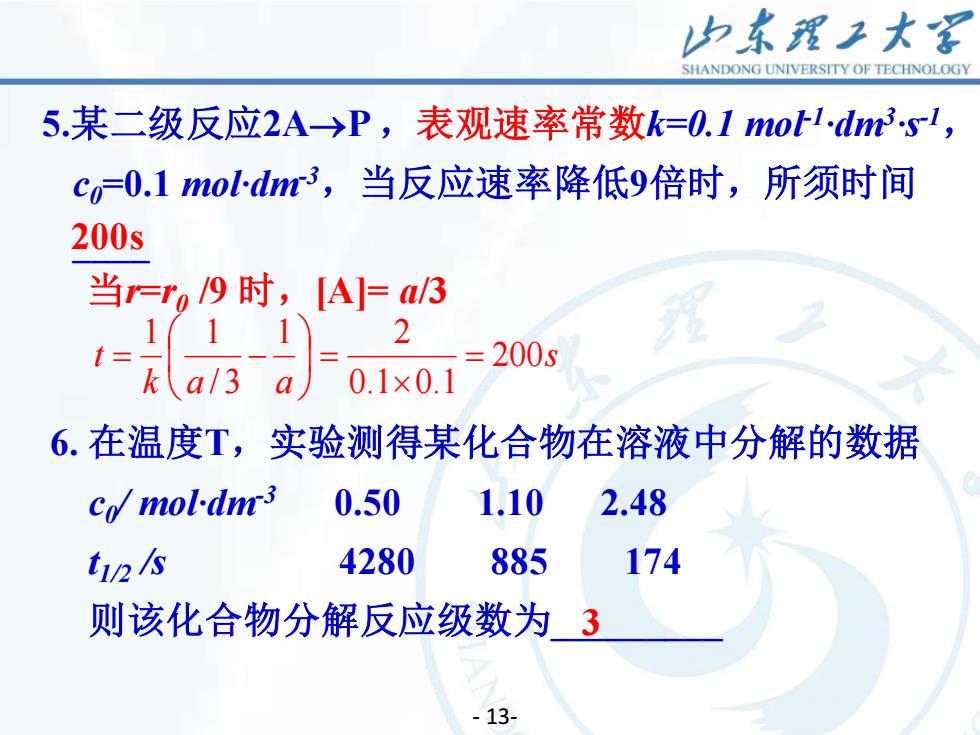
山东理工大客SHANDONGUNIVERSITYOFTECHNOLOGY5.某二级反应2A一>P,表观速率常数k=0.1moll.dm3.s-l,co=0.1 mol·dm3,当反应速率降低9倍时,所须时间200s当r=ro /9 时,[A]= a/3福2200s0.1 x× 0.17/36.在温度T,实验测得某化合物在溶液中分解的数据2.48Co/mol·dm-30.501.101744280885ti/2 /s则该化合物分解反应级数为3- 13-
14 - 13- 5.某二级反应2A→P ,表观速率常数k=0.1 mol-1·dm3·s -1 , c0=0.1 mol·dm-3 ,当反应速率降低9倍时,所须时间 _ 6. 在温度T,实验测得某化合物在溶液中分解的数据 c0 / mol·dm-3 0.50 1.10 2.48 t1/2 /s 4280 885 174 则该化合物分解反应级数为_ 200s 3 当r=r0 /9 时,[A]= a/3 s k a a t 200 0.1 0.1 1 2 / 3 1 1 = = = −

山东理工大享SHANDONGUNIVERSITYOFTECHNOLOGY7.实验测得反应A+B→2C+D速率方程为r=k[A][B]反应历程为A+B→>C+F(ki, slow)F→>C+D(k2 , fast )则k与k的关系为k=kj8.实验测得反应2A+B→>2C+D速率方程为r-k[A][B]以[A]。=2[B]。开始实验,可将方程式改写成则 k,= _1/2kr=k, [A]?14 -
15 - 14 - 7.实验测得反应A+B → 2C+D速率方程为r=k[A][B] 反应历程为 A+B→C+F (k1 , slow) F→C+D (k2 , fast ) 则k1与k的关系为_ 8.实验测得反应2A+B→2C+D速率方程为r=k[A][B] 以[A]0 =2[B]0 开始实验,可将方程式改写成 r=ka [A]2 则 ka = _k k=k1 1/2