
重庆医科大学基础医学院教案(续页) 辅助手段和 基本内容 时间分配 第三习 烯烃 一、烯烃结构特征和分子通式 二、烯烃的命名法 三、顺反异构 四、烯烃的化学性质 五、共轭体系和共轭效应 烯烃结构特征和分子通式 乙烯的结构有三个特性 15 ·1、分子的平面性 2、双健的不等性 3、不可旋转性 1、分子的平面性 ·双键中的两个键是不相同的,一个是由两个碳的s即杂化轨道形成的。 键,另一个是由末杂化的p轨道相互平行所组成的1键。不等性表现 在键能上就是π键的健能比σ健的键能低。 2 双键的不等性 双键中的两个健是不相同的,一个是由两个碳的sD'杂化轨道形成的。 个是由末杂化的P轨道相互平行所组成的π健。不等性表现 不可旋转性 幼道房 成的 。健的旋转,具有不可旋转性。 双键之所以能成为功能团,实质是和键省差别,键且有它白 身的特殊性所性所 较看表2-1,其中最主要的 一点就是π键键能小 极化度大,双键的性质就发生在的断裂上 。健和键和主要特点 0 键 键 可以单独存在,存在于任何共价键 不能单独存在,只能 键同时存在。 中。 皮健轨道沿健轴重叠,重叠程度较 成键P轨道平行重叠 重叠程度较小。 键能大 稳发 大,不被极化 1、健能较小,不稳定。 2、电子云受核约速小,易被极化。 转。 3、成键的两个原子不可沿键轴自由旋转
11 重庆医科大学基础医学院教案(续页) 基本内容 辅助手段和 时间分配 第三章 烯烃 一、烯烃结构特征和分子通式 二、烯烃的命名法 三、顺反异构 四、烯烃的化学性质 五、共轭体系和共轭效应 一、烯烃结构特征和分子通式 乙烯的结构有三个特性 • 1、分子的平面性 • 2、双键的不等性 • 3、不可旋转性 1、分子的平面性 • 双键中的两个键是不相同的,一个是由两个碳的sp 2杂化轨道形成的σ 键, 另一个是由末杂化的p轨道相互平行所组成的π键。不等性表现 在键能上就是π键的键能比σ键的键能低。 2、双键的不等性 • 双键中的两个键是不相同的,一个是由两个碳的sp 2杂化轨道形成的σ 键, 另一个是由末杂化的p轨道相互平行所组成的π键。不等性表现 在键能上就是π键的键能比σ键的键能低。 3、不可旋转性 • π键是两个p轨道相互平行重叠所形成的,一旦成键碳原子绕σ键轴 作相对旋转,就必然使p轨道离开平行状态,所以π键的形成就限制了 σ键的旋转,具有不可旋转性。 • 双健之所以能成为功能团,实质就是π键和σ键有差别,π健具有它自 身的特殊性质。性质比较看表2-1,其中最主要的一点就是π键键能小, 极化度大,双键的性质就发生在π的断裂上。 σ键和π键和主要特点 5 15 σ 键 π 键 存 在 可以单独存在,存在于任何共价键 中。 不能单独存在,只能与σ键同时存在。 形 成 成键轨道沿键轴重叠,重叠程度较 大。 成键P轨道平行重叠,重叠程度较小。 性 质 1、键能大,较稳定。 2、电子云受核约束大,不易被极化。 3、成键的两个原子可沿键轴自由旋 转。 1、键能较小,不稳定。 2、电子云受核约束小,易被极化。 3、成键的两个原子不可沿键轴自由旋转

20 1、轻的系统命 使碳碳双键的位次最小 碳原子数超过10个时,应在烯字前加一“碳”字。取代基的名称位置数目 写在烯烃名称前。 2、烯烃的命名与烯烃类似,只是在“烯”之前加“二”字,并分别注明 两个双键的位置。(选同时含有两个双键的最长碳链为主链,编号时 使两个双健的位置最小,取代基写在母体之前,排列按顺序规则。) 三、顺反异构(cis-trans isomerism 顺反异构的定义: 指由于有机分子中存在阻碍自由旋转的因素(如双键或脂环),在一定条 件下,引起原子或原子团在空间排列方式不同的异构现象。 1、产生顺反异构的原因和条件 (①)产生的原因 碳碳双键中的键的存在,限制了双键碳的自由转动。 (2)产生条件:每个双键碳原子上所连的两个原子或基团不同。 ①a=b,d=e,无顺反异构 ②a=b,d=e或a=b,d≠e,无顺反异构 ③a≠b,d≠e有顺反异构 2、顺反异构的命名 (1)枸型的顺/反命名法 分别连在双键碳上的两个相同的原子或基团处在双键同侧时(即a=d 或b=e),称为顺式:处在异侧时(即a=e或b=d),称为反式 若分子中含有一个以上的双键,且存在顺反异构,命名时 每个双键部付 标明,并从主链编号较小的一端起依次列出,其间用逗号隔开, 放在 的。开这腿的化合物中。主链的编号有选择时。则细号应从顺型双 7金过 地四个工或题亚时不能用反、 用2/E命名法 字母,表示“一起 。/命名法规定先定出每个双键碳上所连的两个原子或基团的优先顺 ,若两个优先的原子或基团处在双键的同侧,称为型,反之则为 型 若ah日d>0 原子或基团的优先性由“顺序规则”决定。顺序规则的主要原则是比较厉 子序数大小。原子序数较大的原子较优先。 ·①与双键碳直接相连的原子不同时,原子序数大者为优先。对同位素, 原子量大者为优先。 -I>-Br>-Cl>-SH>-0H>-NH:>-CH>-D>-H ·②若取代基中与双键碳直接相连的原子相同时,则比较与该原子后面直 接相连的原子,直到比出大小为止。 12
12 二、烯烃的命名法 1、烯烃的系统命名法基本与烷烃相似,要点是选择含有双键的最长碳链 做主链,从靠近碳碳双键的一端编号,使碳碳双键的位次最小,如主链的 碳原子数超过10个时,应在烯字前加一“碳”字。取代基的名称位置数目 写在烯烃名称前。 2、 烯烃的命名与烯烃类似,只是在“烯”之前加“二”字,并分别注明 两个双键的位置。(选同时含有两个双键的最长碳链为主链,编号时 使两个双键的位置最小,取代基写在母体之前,排列按顺序规则。) 三、顺反异构(cis-trans isomerism) 顺反异构的定义: 指由于有机分子中存在阻碍自由旋转的因素(如双键或脂环),在一定条 件下,引起原子或原子团在空间排列方式不同的异构现象。 1、产生顺反异构的原因和条件 • (1) 产生的原因 碳碳双键中的π键的存在,限制了双键碳 的自由转动。 • (2)产生条件:每个双键碳原子上所连的 两个原子或基团不同。 ①a = b,d = e,无顺反异构 ②a = b,d = e或a = b,d≠e, 无顺反异构 ③a≠b,d≠e 有顺反异构 2、顺反异构的命名 (1)构型的顺/反命名法 分别连在双键碳上的两个相同的原子或基团处在双键同侧时(即a =d 或b = e),称为顺式;处在异侧时(即a = e或b = d),称为反式 若分子中含有一个以上的双键,且存在顺反异构,命名时,每个双键部位 的构型均须标明,并从主链编号较小的一端起依次列出,其间用逗号隔开, 放在名称之前。 在含有多个双键的化合物中,主链的编号有选择时,则编号应从顺型双键 的一端开始。 (2)构型的Z/E命名法 • 当双键碳上的四个原子或基团互不相同时,不能用顺/反命名法,只能 用Z/E命名法。Z是德文Zusammen的第一个字母,表示“一起”;E为德 文Entgegen的第一个字母,为相反之意。 • Z/E命名法规定:先定出每个双键碳上所连的两个原子或基团的优先顺 序,若两个优先的原子或基团处在双键的同侧,称为Z型,反之则为E 型。 若a > b 且d > e, 原子或基团的优先性由“顺序规则”决定。顺序规则的主要原则是比较原 子序数大小。原子序数较大的原子较优先。 • ①与双键碳直接相连的原子不同时,原子序数大者为优先。对同位素, 原子量大者为优先。 -I>-Br>-Cl>-SH>-OH>-NH2>-CH3>-D>-H • ②若取代基中与双键碳直接相连的原子相同时,则比较与该原子后面直 接相连的原子,直到比出大小为止。 20 30

③若第一个原子以双键或三键与其它原子相连时,则把它看作与两个或三 个其它原子以单键相连。 Z/E命名实例 H 顺,反-2,5-庚二烯 HaC H Br、 H (E)-1-氯-2-溴丙烯 H:C ci 9 Br C=c (Z)1,2-二氯-1-溴丙烯 或反-1,2-二氯-1-淚丙烯 8- (2E,4Z)-5-甲基-2,4-庚二烯 CH.CH H H 顺反异构的性质差别 质一般来说,反式有较高的熔沸点,较低的溶解度 比顺式来说具有较 称性 使分子 用力增大所至」 在生理活性方面,顺反异构体的生理话性是不同的 些是顺式强,有些是反 四、烯烃的化学性质 30 (-)加成反应(addition reaction)) ·加成反应是指两分子或多个分子相加而成一个分子的反应 1、加氢反应 ·烯烃在催化剂Ni,P,P1等作用下与氢反应生成烷烃 R-CH-CH2+R-CH-CH 2、加卤素反应 。烯烃在常温下可以与卤素进行加成反应。 R-CH=CH+B2D→R-CH-C Br Br 此反应可用来鉴别化合物中是否含有双健。 ·烃与氯的加成要在催化剂FeC1,的作用下进行。 西化 (1)对称烯烃与卤化氢加成 →CH一9H-C 13
13 ③若第一个原子以双键或三键与其它原子相连时,则把它看作与两个或三 个其它原子以单键相连. Z/E命名实例 顺,反-2,5-庚二烯 (E)-1-氯-2-溴丙烯 (Z)-1,2-二氯-1-溴丙烯 或 反-1,2-二氯-1-溴丙烯 (2E,4Z)-5-甲基-2,4-庚二烯 3、顺反异构的性质差别 • 顺反异构体的物理性质一般来说,反式有较高的熔沸点,较低的溶解度。 这是由于反式异构体的分子比顺式来说具有较高的对称性,使分子间作 用力增大所至。在生理活性方面,顺反异构体的生理活性是不同的,有 些是顺式强,有些是反式强。 四、烯烃的化学性质 (一)加成反应(addition reaction) • 加成反应是指两分子或多个分子相加而成一个分子的反应。 1、加氢反应 • 烯烃在催化剂Ni,Pd,Pt等作用下与氢反应生成烷烃。 2、加卤素反应 • 烯烃在常温下可以与卤素进行加成反应。 • 此反应可用来鉴别化合物中是否含有双键。 • 炔烃与氯的加成要在催化剂Fe Cl3的作用下进行。 3、加卤化氢反应 • (1)对称烯烃与卤化氢加成 30 R CH CH2 + H2 R CH2 CH3 催催催 CH3 CH CH2 CH3 CH2 CH2 Cl CH3 CH Cl CH3 HCl H C H3C C H CH2 C C H CH3 H 1 2 3 4 5 6 7 C H Cl C H3C Br Cl C H3C C Br Cl H3C C CH3CH2 C H C H C H CH3 1 3 2 5 4 6 R CH CH2 +Br2 R CH CH2 Br Br 催催

·(2)不对称烯经与卤化氢加成 马尔可夫尼可夫Marko mikof)却则 。当不对称烯烃与不对称试剂加成时,不对称试剂中带负电的部分总是加 到含氢最少的双键碳原子上,而氢原子总是加到含氢较多的双键碳原子 上,叫马氏规则。 ·常见的不对称试剂:卤化氢、H0、HS0、HOC1等。 3、烯烃亲电加成反应的历程: B6口 c-ct H B6 H H _Br H 第一步、乙烯和溴分子的极化,溴偶极分子中带正电荷的一端可与键形 成π络合物 c Br H r H →H-C-C-H H Br 亲电取代反应的要点: :8界食导鞋资资种故及的是香分王电有 的溴原子,它是一种亲电试剂,所以双健的加成反应属亲电加反应。 加成反 正碳离子的稳定性解释马氏规则 C格H→cH-c-C→cH-c 电荷愈分散, 体系就愈稳定。正碳离子上的碳上斥电子基愈多,电荷就 愈分散,正碳离子就愈稳定。 14
14 • (2)不对称烯烃与卤化氢加成 马尔可夫尼可夫(Markownikoff)规则: • 当不对称烯烃与不对称试剂加成时,不对称试剂中带负电的部分总是加 到含氢最少的双键碳原子上,而氢原子总是加到含氢较多的双键碳原子 上,叫马氏规则。 • 常见的不对称试剂:卤化氢、H2O、H2SO4、HOCl等。 • 3、 烯烃亲电加成反应的历程: 第一步、乙烯和溴分子的极化,溴偶极分子中带正电荷的一端可与π键形 成π络合物 第二步,溴负离子进攻溴 翁离子中的一个碳原子得到加成产物, 连二溴 烷烃。 亲电取代反应的要点: • ① 反应的过程有离子生成和变化,故属于离子反应。 • ② 两个溴原子的加成是分步进行的,首先进攻双键的是带部分正电荷 的溴原子,它是一种亲电试剂,所以双键的加成反应属亲电加反应。 • ③ 加成是分步进行的,中间体为正碳离子。 • ④ 双键的电子云密度愈高,愈有利于反应。(如:丙烯比乙烯易发生 加成反应) 正碳离子的稳定性解释马氏规则 • 电荷愈分散,体系就愈稳定。正碳离子上的碳上斥电子基愈多,电荷就 愈分散,正碳离子就愈稳定。 C=C H H H H + Br Br δ + δ _ C H H Br H H C Br δ + δ -催 C H H Br H H C + —Br - C H H Br H H C + Br - C C H Br H Br H H CH3 CH CH2 CH3 CH Cl CH3 HCl δ+δ- CH3 CH CH3 CH3 CH2 CH2 CH3 CH2 CH2 Cl H + Cl - H + Cl - + +
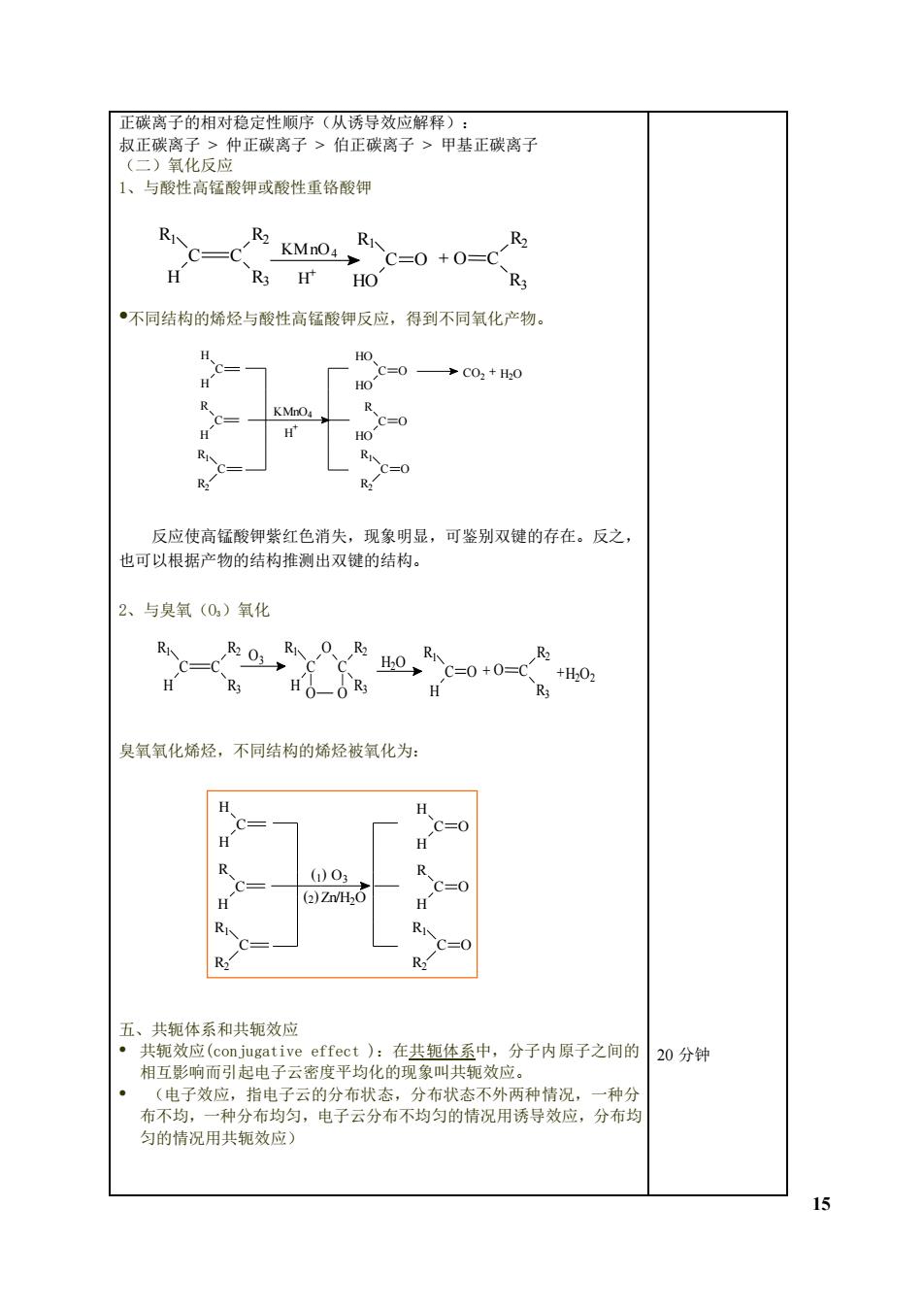
正碳离子的相对稳定性顺序(从诱导效应解释): 叔正碳离子>仲正碳离子>伯正碳离子>甲基正碳离子 (二)氧化反应 1、与酸性高锰酸钾或酸性重铬酸钾 R c=c .C=0+ H R3 H HO R 不同结构的烯烃与酸性高锰酸钾反应,得到不同氧化产物 HO =0 →C02+0 c=o 反应使高锰酸钾紫红色消失,现象明显,可鉴别双键的存在。反之, 也可以根据产物的结构推测出双键的结构。 2、与臭氧(0)氧化 R R C=0+0=( HOOR3 H 臭氧氧化烯烃,不同结构的烯烃被氧化为 H 03 2)ZnH( R 五、共轭体系和共轭效应 引起电于度平均化在共知体系中,分子内原子之间的 20分钟 引起 子云密度 匀的情况用共效应 15
15 正碳离子的相对稳定性顺序(从诱导效应解释): 叔正碳离子 > 仲正碳离子 > 伯正碳离子 > 甲基正碳离子 (二)氧化反应 1、与酸性高锰酸钾或酸性重铬酸钾 •不同结构的烯烃与酸性高锰酸钾反应,得到不同氧化产物。 反应使高锰酸钾紫红色消失,现象明显,可鉴别双键的存在。反之, 也可以根据产物的结构推测出双键的结构。 2、与臭氧(O3)氧化 臭氧氧化烯烃,不同结构的烯烃被氧化为: 五、共轭体系和共轭效应 • 共轭效应(conjugative effect ):在共轭体系中,分子内原子之间的 相互影响而引起电子云密度平均化的现象叫共轭效应。 • (电子效应,指电子云的分布状态,分布状态不外两种情况,一种分 布不均,一种分布均匀,电子云分布不均匀的情况用诱导效应,分布均 匀的情况用共轭效应) 20 分钟 C O HO R1 + O C R3 R2 C C R1 H R2 R3 KMnO4 H + C H H C R H C R1 R2 KMnO4 H + C O HO HO C O R HO C O R1 R2 CO2 + H2O O3 C O O C O R1 H R2 R3 H2O C O H R1 + O C R3 R2 +H2O2 C C R1 H R2 R3 C H H C R H C R1 R2 C O H H C O R H C O R1 R2 O3 (1 ) (2 ) Zn/H2O