
GB 中华人民共和国国家标准 GB4789.2—2010 食品安全国家标准 食品微生物学检验菌落总数测定 National food safety standard Food microbiological examination:Aerobic plate count 2010-03-26发布 2010-06-01实施 中华人民共和国卫生部 发布
中华人民共和国国家标准 GB 4789.2—2010 食品安全国家标准 食品微生物学检验 菌落总数测定 National food safety standard Food microbiological examination:Aerobic plate count 中华人民共和国卫生部 发布 2010-03-26 发布 2010-06-01 实施

GB4789.2-2010 前言 本标准代替GB/T47892-2008《食品卫生微生物学检验南落总数测定》。 本标准与GBT4789.2-2008相比,主要修改如下: 一修改了标准的中英文名称: —修改了菌落总数计算公式中的解释 一修改了培养基和试剂: 一别除了第二法菌落总数PetrifilmTM测试片法 本标准的附录A是规范性附录。 本标准所代替标准的历次版本发布情况为: GB4789.2-1984、GB4789.2-1994、GB/T4789.2-2003、GB/T4789.2-2008
GB 4789.2—2010 I 前 言 本标准代替GB/T 4789.2-2008《食品卫生微生物学检验 菌落总数测定》。 本标准与GB/T 4789.2-2008相比,主要修改如下: ——修改了标准的中英文名称; ——修改了菌落总数计算公式中的解释; ——修改了培养基和试剂; ——删除了第二法 菌落总数PetrifilmTM 测试片法。 本标准的附录A是规范性附录。 本标准所代替标准的历次版本发布情况为: ——GB 4789.2-1984、GB 4789.2-1994、GB/T 4789.2-2003、GB/T 4789.2-2008

GB4789.2-2010 食品安全国家标准 食品微生物学检验菌落总数测定 1范围 本标准规定了食品中菌落总数(Aerobic plate coun)的测定方法。 本标准适用于食品中菌落总数的测定。 2术语和定义 2.1菌落总数aerobic plate count 食品检样经过处理,在一定条件下(如培养基、培养温度和培养时间等)培养后,所得每g(mL) 检样中形成的微生物菌落总数 3设备和材料 除微生物实验室常规灭菌及培养设备外,其他设备和材料如下: 3.1恒温培养箱:36℃±1℃,30C1℃。 3.2冰箱:2℃~5℃, 3.3恒温水浴箱:46℃±1℃。 3.4天平:感量为0.1g。 3.5均质器。 3.6振荡器。 3.7无菌吸管:1mL(具0.01mL刻度)、10mL(具0.1mL刻度)或微量移液器及吸头。 3.8无南锥形瓶:容量250mL、500mL 3.9无菌培养皿:直径90mm。 3.10pH计或pH比色管或精密pH试纸。 3.11放大镜或/和菌落计数器。 4培养基和试剂 4.1平板计数琼脂培养基:见附录A中A1。 4.2磷酸盐缓冲液:见附录A中A2
GB 4789.2—2010 1 食品安全国家标准 食品微生物学检验 菌落总数测定 1 范围 本标准规定了食品中菌落总数(Aerobic plate count)的测定方法。 本标准适用于食品中菌落总数的测定。 2 术语和定义 2.1 菌落总数 aerobic plate count 食品检样经过处理,在一定条件下(如培养基、培养温度和培养时间等)培养后,所得每g(mL) 检样中形成的微生物菌落总数。 3 设备和材料 除微生物实验室常规灭菌及培养设备外,其他设备和材料如下: 3.1 恒温培养箱:36 ℃±1 ℃,30 ℃±1 ℃。 3.2 冰箱:2 ℃~5 ℃。 3.3 恒温水浴箱:46 ±1 ℃ ℃。 3.4 天平:感量为 0.1 g。 3.5 均质器。 3.6 振荡器。 3.7 无菌吸管:1 mL(具 0.01 mL 刻度)、10 mL(具 0.1 mL 刻度)或微量移液器及吸头。 3.8 无菌锥形瓶:容量 250 mL、500 mL。 3.9 无菌培养皿:直径 90 mm。 3.10 pH 计或 pH 比色管或精密 pH 试纸。 3.11 放大镜或/和菌落计数器。 4 培养基和试剂 4.1 平板计数琼脂培养基:见附录 A 中 A.1。 4.2 磷酸盐缓冲液:见附录 A 中 A.2
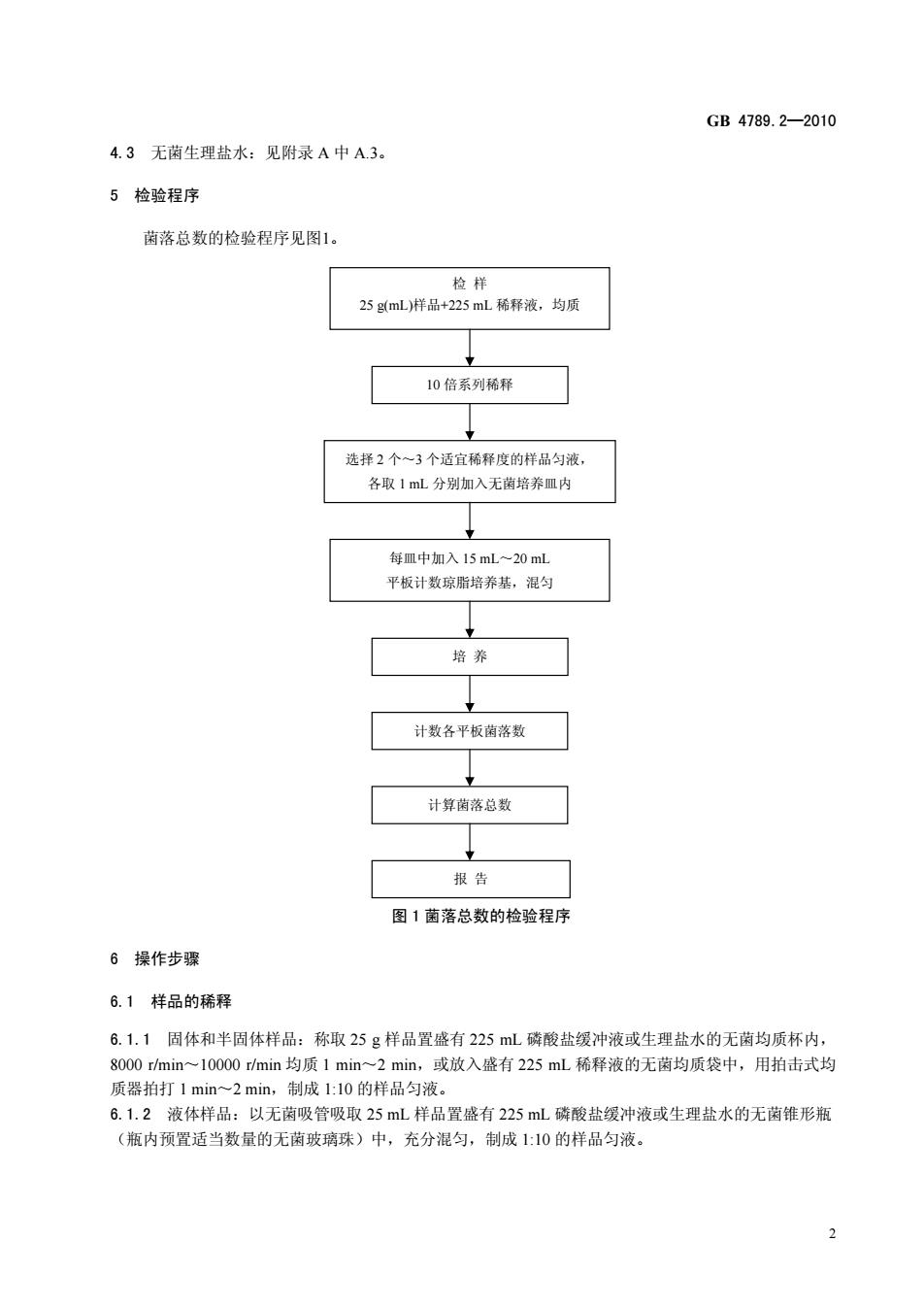
GB4789.2-2010 4.3无菌生理盐水:见附录A中A3。 5检验程序 菌落总数的检验程序见图1 检样 25L样品+25L稀释流。均质 10倍系列稀释 选择2个一3个话宜稀释度的样品匀液」 各取1ml分别加入无菌培养皿内 每m中加入15mL~20mL 平板计数琼脂培养基,混匀 培养 计数各平板菌落数 计算菌落总数 报告 图1落总数的检验程序 6操作步骤 6.1样品的稀释 6.1.1固体和半固体样品:称取25g样品置盛有225mL磷酸盐缓冲液或生理盐水的无南均质杯内 8000rmin~10000min均质1min~2min,或放入盛有225mL稀释液的无菌均质袋中,用拍击式均 质器拍打1min~2min,制成L:10的样品匀液。 6.1.2液体样品:以无菌吸管吸取25mL样品置盛有225mL磷酸盐缓冲液或生理盐水的无菌锥形瓶 (瓶内预置适当数的无菌玻璃珠)中,充分混匀,制成1:10的样品匀液
GB 4789.2—2010 2 4.3 无菌生理盐水:见附录 A 中 A.3。 5 检验程序 菌落总数的检验程序见图1。 图 1 菌落总数的检验程序 6 操作步骤 6.1 样品的稀释 6.1.1 固体和半固体样品:称取 25 g 样品置盛有 225 mL 磷酸盐缓冲液或生理盐水的无菌均质杯内, 8000 r/min~10000 r/min 均质 1 min~2 min,或放入盛有 225 mL 稀释液的无菌均质袋中,用拍击式均 质器拍打 1 min~2 min,制成 1:10 的样品匀液。 6.1.2 液体样品:以无菌吸管吸取 25 mL 样品置盛有 225 mL 磷酸盐缓冲液或生理盐水的无菌锥形瓶 (瓶内预置适当数量的无菌玻璃珠)中,充分混匀,制成 1:10 的样品匀液。 36 ℃±1 ℃ 48 h±2 h 检 样 25 g(mL)样品+225 mL 稀释液,均质 10 倍系列稀释 选择 2 个~3 个适宜稀释度的样品匀液, 各取 1 mL 分别加入无菌培养皿内 培 养 计数各平板菌落数 计算菌落总数 每皿中加入 15 mL~20 mL 平板计数琼脂培养基,混匀 报 告

GB4789.2-2010 6.1.3用1mL无茵吸管或微量移液器吸取1:10样品匀液1mL,沿管壁缓慢注于盛有9mL稀释液的 无菌试管中(注意吸管或吸头尖端不要触及稀释液面),振摇试管或换用1支无菌吸管反复吹打使其混 合均匀,制成1:100的样品匀液。 6.1.4按6.1.3操作程序,制备10倍系列稀释样品匀液。每递增稀释一次,换用1次1mL无菌吸管 或吸头。 6.1.5根据对样品污染状况的估计,选择2个一3个适宜稀释度的样品匀液(液体样品可包括原液), 在进行10倍递增稀释时,吸取1mL样品匀液于无菌平皿内,每个稀释度做两个平皿。同时,分别吸 取1mL空白稀释液加入两个无菌平皿内作空白对照 6.1.6及时将15mL~20mL冷却至46℃的平板计数琼脂培养基(可放置于46℃±1℃恒温水浴箱中 保温)倾注平皿,并转动平皿使其混合均匀。 6.2培养 6.2.1待琼脂凝固后,将平板翻转,36℃±1℃培养48hd2h。水产品30℃±1℃培养72ht3h。 6.2.2如果样品中可能含有在琼脂培养基表面弥漫生长的菌落时,可在凝固后的琼脂表面覆盖一薄层 琼脂培养基(约4mL),凝固后翻转平板,按6.2.1条件进行培养。 6.3菌落计数 可用肉眼观察,必要时用放大镜或南落计数器,记录稀释倍数和相应的南落数最。南落计数以南落 形成单位(colony-forming units,.CFU)表示。 6.3.1选取南落数在30CFU一300CFU之间、无感延南落生长的平板计数菌落总数。低于30CFU的 平板记录具体茵落数,大于300C℉U的可记录为多不可计。每个稀释度的菌落数应采用两个平板的平 均数。 6.3.2其中一个平板有较大片状菌落生长时,则不宜采用,而应以无片状菌落生长的平板作为该稀释 度的茵落数:若片状菌落不到平板的一半,而其余一半中菌落分布又很均匀,即可计算半个平板后乘以 2,代表一个平板茵落数 6,3.3当平板上出现南落间无明显界线的链状生长时,则将每条单链作为一个菌落计数。 7结果与报告 7.1菌落总数的计算方法 7.1.1若只有一个稀释度平板上的菌落数在适宜计数范围内,计算两个平板茵落数的平均值,再将平 均值乘以相应稀释倍数,作为每g(mL)样品中菌落总数结果。 7.1.2若有两个连续稀释度的平板菌落数在适宜计数范围内时,按公式(1)计算: w=∑c /(n+0.ln2)d 式中 N一样品中茵落数: C一平板(含适宜范围菌落数的平板)菌落数之和: 一第一稀释度(低稀释倍数)平板个数: 一第二稀释度(高稀释倍数)平板个数: d—稀释因子(第一稀释度)
GB 4789.2—2010 3 6.1.3 用 1 mL 无菌吸管或微量移液器吸取 1:10 样品匀液 1 mL,沿管壁缓慢注于盛有 9 mL 稀释液的 无菌试管中(注意吸管或吸头尖端不要触及稀释液面),振摇试管或换用 1 支无菌吸管反复吹打使其混 合均匀,制成 1:100 的样品匀液。 6.1.4 按 6.1.3 操作程序,制备 10 倍系列稀释样品匀液。每递增稀释一次,换用 1 次 1 mL 无菌吸管 或吸头。 6.1.5 根据对样品污染状况的估计,选择 2 个~3 个适宜稀释度的样品匀液(液体样品可包括原液), 在进行 10 倍递增稀释时,吸取 1 mL 样品匀液于无菌平皿内,每个稀释度做两个平皿。同时,分别吸 取 1 mL 空白稀释液加入两个无菌平皿内作空白对照。 6.1.6 及时将 15 mL~20 mL 冷却至 46 ℃的平板计数琼脂培养基(可放置于 46 ±1 ℃ ℃恒温水浴箱中 保温)倾注平皿,并转动平皿使其混合均匀。 6.2 培养 6.2.1 待琼脂凝固后,将平板翻转,36 ±1 ℃ ℃培养 48 h±2 h。水产品 30 ±1 ℃ ℃培养 72 h±3 h。 6.2.2 如果样品中可能含有在琼脂培养基表面弥漫生长的菌落时,可在凝固后的琼脂表面覆盖一薄层 琼脂培养基(约 4 mL),凝固后翻转平板,按 6.2.1 条件进行培养。 6.3 菌落计数 可用肉眼观察,必要时用放大镜或菌落计数器,记录稀释倍数和相应的菌落数量。菌落计数以菌落 形成单位(colony-forming units,CFU)表示。 6.3.1 选取菌落数在 30 CFU~300 CFU 之间、无蔓延菌落生长的平板计数菌落总数。低于 30 CFU 的 平板记录具体菌落数,大于 300 CFU 的可记录为多不可计。每个稀释度的菌落数应采用两个平板的平 均数。 6.3.2 其中一个平板有较大片状菌落生长时,则不宜采用,而应以无片状菌落生长的平板作为该稀释 度的菌落数;若片状菌落不到平板的一半,而其余一半中菌落分布又很均匀,即可计算半个平板后乘以 2,代表一个平板菌落数。 6.3.3 当平板上出现菌落间无明显界线的链状生长时,则将每条单链作为一个菌落计数。 7 结果与报告 7.1 菌落总数的计算方法 7.1.1 若只有一个稀释度平板上的菌落数在适宜计数范围内,计算两个平板菌落数的平均值,再将平 均值乘以相应稀释倍数,作为每 g(mL)样品中菌落总数结果。 7.1.2 若有两个连续稀释度的平板菌落数在适宜计数范围内时,按公式(1)计算: …………………………………(1) 式中: N——样品中菌落数; ∑C——平板(含适宜范围菌落数的平板)菌落数之和; n1——第一稀释度(低稀释倍数)平板个数; n2——第二稀释度(高稀释倍数)平板个数; d——稀释因子(第一稀释度)。 n n d C N ( 0.1 ) 1 + 2 = ∑