
§6-2热力学第一定律对于理想气体 准静态过程的应用 一、等体过程气体的摩尔定体热容 等体过程: 系统体积在状态变化过程中始终保持不变。 dy =0 A=0或dA=0 P2 do,dE P Q=E2-E,=△E / 等体过程中,系统对外不作功,吸收的热量 全用于增加内能
上页 下页 返回 退出 系统体积在状态变化过程中始终保持不变。 dV = 0 A A = = 0 d 0 或 QV = E2 − E1 = E dQV = dE 等体过程: 等体过程中,系统对外不作功,吸收的热量 全用于增加内能。 §6-2 热力学第一 定律对于理想气体 准静态过程的应用 一、 等体过程 气体的摩尔定体热容 p O V 1 2 V 2 p 1 p

摩尔定体热容 1mol气体在体积不变时,温度改变1K时所吸收或放 出的热量。 C R dE dT dT 2 即:理想气体的摩尔定体热容是一个只与分子自由 度有关的量。 等体吸热 m Cy(T2-T) 等体内能增量 △E = m Mmol Cv(T,-T),适应于所有过程 让美觉返司退此
上页 下页 返回 退出 等体吸热 即:理想气体的摩尔定体热容是一个只与分子自由 度有关的量。 ,适应于所有过程 1 mol气体在体积不变时,温度改变1K时所吸收或放 出的热量。 d d = d d 2 V V Q E i C R T T = =2 1 mol ( ) V V m Q C T T M = − 2 1 mol ( ) V m E C T T M = − 摩尔定体热容 等体内能增量

二、等压过程气体的摩尔定压热容 等压过程: 系统压强在状态变化过程中始终保持不变。 dp 0 m ΛE= CY(T2-TD 2 A=pdv-p(V;-V) R(T-T) Mmol 上美子意道可退此
上页 下页 返回 退出 等压过程: 系统压强在状态变化过程中始终保持不变。 d 0 p = 2 1 mol ( ) V m E C T T M = − 2 1 2 1 d ( ) V V A p V p V V = = − 2 1 mol ( ) m R T T M = − p O V 1 2 二、 等压过程 气体的摩尔定压热容

=AE+p(V2-V) Op=AE+A= m(Cr+R)(T:-T) M 在等压过程中,理想气体吸热的一部分用于增 加内能,另一部分用于对外作功。 摩尔定压热容: 1mol气体在压力不变时,温度改变1K时所吸收或放 出的热量。 do dE+pdy dE pdv=iR+R dT dT dT dT 2 江美不意返司退此
上页 下页 返回 退出 2 1 mol ( )( ) p V m Q E A C R T T M = + = + − 在等压过程中,理想气体吸热的一部分用于增 加内能,另一部分用于对外作功。 摩尔定压热容: 1 mol气体在压力不变时,温度改变1K时所吸收或放 出的热量。 d d d d d d d d d 2 p Q E p V E p V i C R R T T T T + = = = + = + 2 1 ( ) Q E p V V p = + −
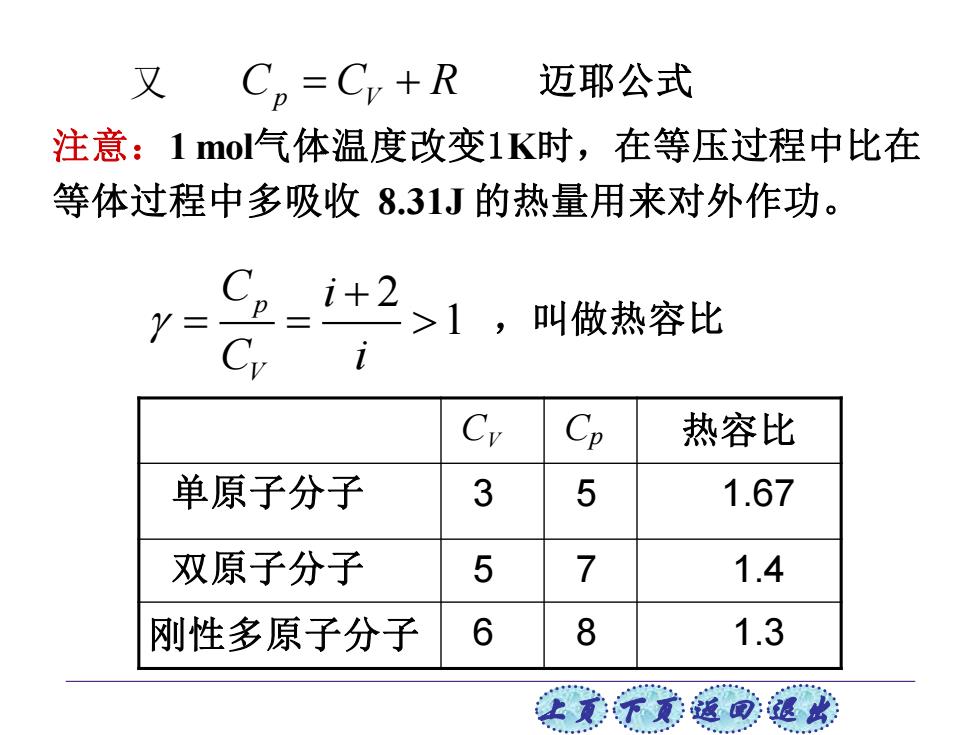
又 Cp=Cr+R 迈耶公式 注意:1mol气体温度改变1K时,在等压过程中比在 等体过程中多吸收8.31J的热量用来对外作功。 Y= i+2>1,叫做热容比 Cp 1 Cy Cp 热容比 单原子分子 3 5 1.67 双原子分子 5 7 1.4 刚性多原子分子 6 8 1.3 上学意滋回退
上页 下页 返回 退出 又 迈耶公式 注意:1 mol气体温度改变1K时,在等压过程中比在 等体过程中多吸收 8.31J 的热量用来对外作功。 C C R p V = +2 1 p V C i C i + = = ,叫做热容比 CV Cp 热容比 单原子分子 3 5 1.67 双原子分子 5 7 1.4 刚性多原子分子 6 8 1.3