§5-9真实气体 范德瓦尔斯方程 一、真实气体等温线 理想气体 忽略分子的体积与分子间的引力 实际气体 温度不太低 压强不太高 理想气体 让美觉返司退
上页 下页 返回 退出 理想气体 实际气体 温度不太低 压强不太高 忽略分子的体积与分子间的引力 理想气体 *§ 5-9 真实气体 范德瓦尔斯方程 一、 真实气体等温线
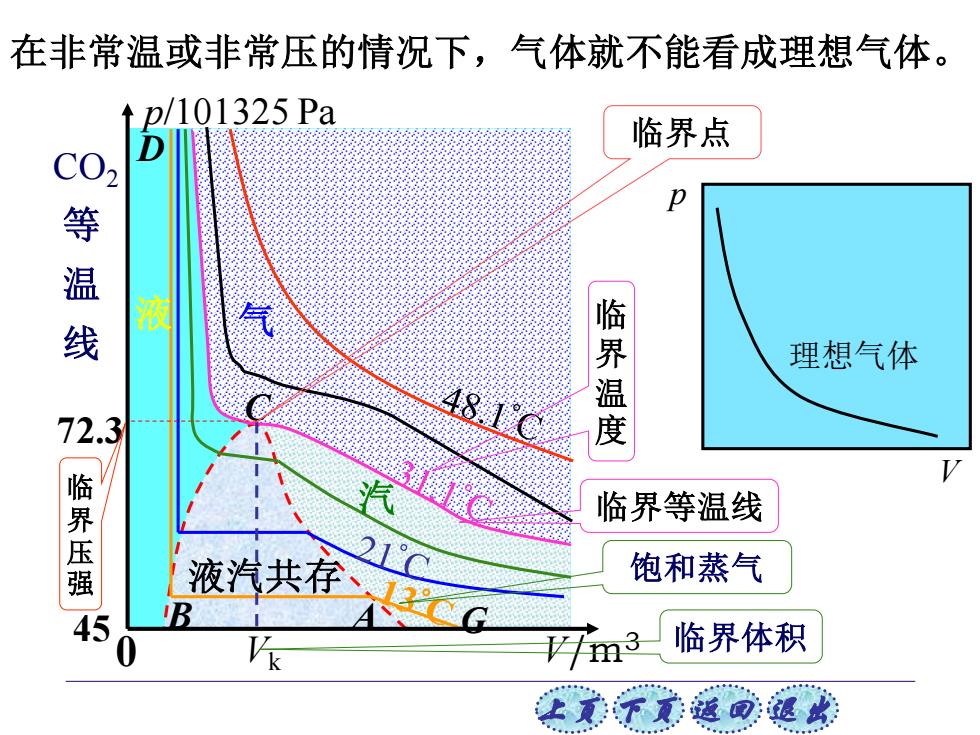
在非常温或非常压的情况下,气体就不能看成理想气体。 p/101325Pa 临界点 p 等温线 液 理想气体 72.3 48.1C 临界温度 临界压强 临界等温线 液汽共c 21C 饱和蒸气 45 a3, 临界体积 女意子意适司退此
上页 下页 返回 退出 V/m3 C Vk 72.3 450 气 液汽共存 液 p/101325 Pa B A D G 汽 CO2 等 温 线 临 界 压 强 临界等温线 临 界 温 度 临界点 临界体积 饱和蒸气 在非常温或非常压的情况下,气体就不能看成理想气体。 理想气体 p V

真实气体的等温线可以分成四个区域: 汽态区(能液化),液汽共存区,液态区,气态区 (不能液化)。 饱和蒸气压(汽液共存时的压强)与体积无关。 临界点以下汽体可等温压缩液化,以上气 体不能等温压缩液化。 在临界等温曲线的拐点处的温度、压强、 体积分别称为临界温度T、临界压强P和 临界体积Vk。 让美下觉返同速
上页 下页 返回 退出 饱和蒸气压(汽液共存时的压强)与体积无关。 临界点以下汽体可等温压缩液化,以上气 体不能等温压缩液化。 真实气体的等温线可以分成四个区域: 汽态区(能液化),液汽共存区,液态区,气态区 (不能液化)。 在临界等温曲线的拐点处的温度、压强、 体积分别称为临界温度 、临界压强 和 临界体积 。 Tk pk Vk
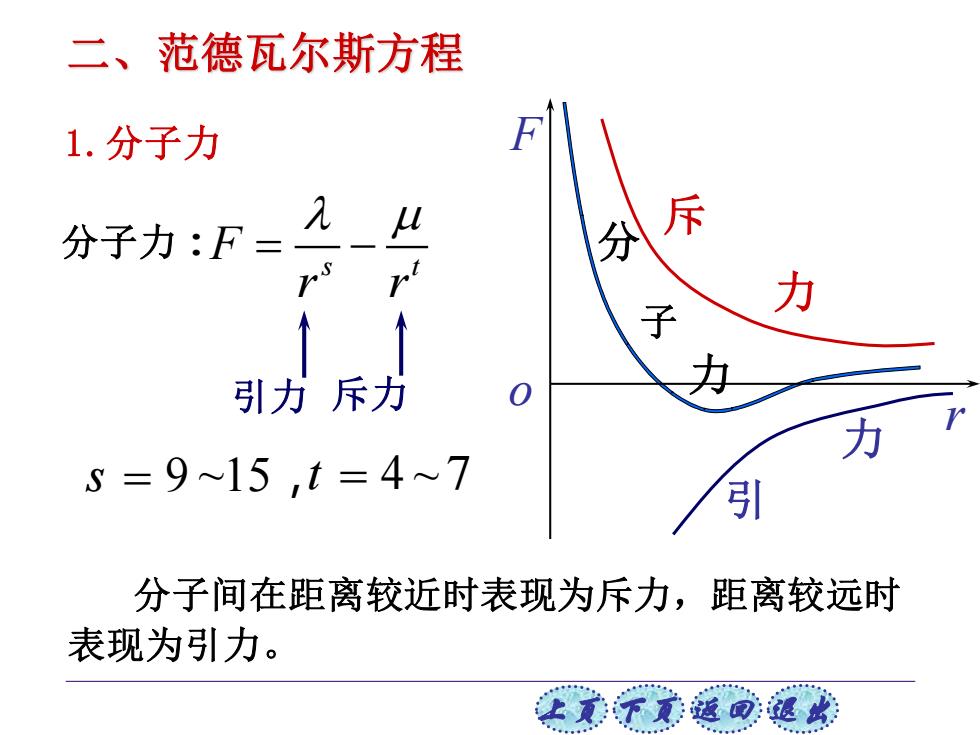
二、范德瓦尔斯方程 1.分子力 分子力:F= A u 分斥 力 引力斥力 力 5=9~15,t=4~7 引 分子间在距离较近时表现为斥力,距离较远时 表现为引力
上页 下页 返回 退出 分子力: s = 9 ~15,t = 4 ~7 引力 斥力 力 分 子 斥 力 引 力 r F o 分子间在距离较近时表现为斥力,距离较远时 表现为引力。 s t F r r = − 1.分子力 二、范德瓦尔斯方程

2.对体积的修正 1mol理想气体的状态方程可写成 pV =RT 每个分子可以自由活动的空间体积。理想 m 气体,分子无大小,故它也是容器的体积。 p 实际测量值。 分子有大小时,则每个分子活动的自由空间必 然小于V,因此可从Vm中减去一个反映分子咱占 有体积的修正量b,状态方程改写为 p(Vin -b)=RT 让美下元返回:退欢
上页 下页 返回 退出 1mol 理想气体的状态方程可写成 m pV RT = 分子有大小时,则每个分子活动的自由空间必 然小于Vm,因此可从Vm 中减去一个反映分子咱占 有体积的修正量b,状态方程改写为 2.对体积的修正 ——每个分子可以自由活动的空间体积。理想 气体,分子无大小,故它也是容器的体积。 Vm p ——实际测量值。 m p V b RT ( ) − =